Considere as substâncias cujas estruturas estão representadas a seguir:
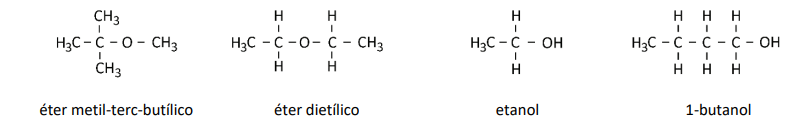
a) Considerando que tanto o etanol quanto o 1-butanol interagem por ligação de hidrogênio com a água, por que o etanol é mais solúvel em água do que o 1-butanol à mesma temperatura?
b) Escreva, no quadro da folha de respostas, as estruturas de dois álcoois que são isômeros do 1-butanol.

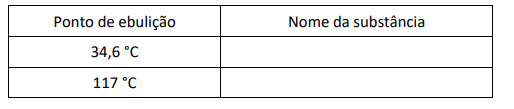
c) O 1-butanol e o éter dietílico são compostos que possuem a mesma fórmula química, C4H10O, porém pontos de ebulição diferentes, sendo que um deles entra em ebulição a 34,6 °C e o outro, a 117 °C a 1 atm. Preencha o quadro, na folha de respostas, relacionando os nomes das substâncias com os respectivos pontos de ebulição. Justifique sua resposta.
a) Apesar de ambos os álcoois interagirem com a água por meio de interações do tipo ligação de hidrogênio, a solubilidade desses compostos em água também é influenciada pelo tamanho de sua cadeia carbônica, que apresenta caráter apolar. O etanol, por apresentar menor cadeia carbônica do que o 1-butanol, possui um caráter polar mais acentuado, apresentando, dessa maneira, maior solubilidade em água (polar).
b) 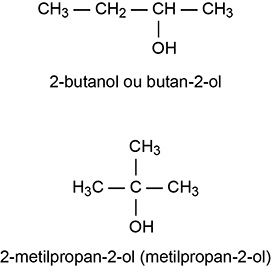
c) Ponto de ebulição: 34,6°C
Nome da substância: éter dietílico
Ponto de ebulição: 117°C
Nome da substância: 1 – butanol
A substância 1-butanol apresenta, entre as suas moléculas, interações intermoleculares do tipo ligação de hidrogênio, mais intensas do que as interações intermoleculares do tipo dipolo permanente do éter dietílico, resultando em uma maior temperatura de ebulição do álcool quando comparado ao éter isomérico.