Considere a fórmula do sal lactato de cálcio hidratado, empregado como repositor de cálcio.

Quando aquecido a 120 ºC, o sal hidratado transforma-se no sal anidro. Em um experimento, 30,8 g de lactato de cálcio hidratado foram aquecidos, originando 21,8 g de sal anidro. Logo, o valor de x na fórmula apresentada é igual a
Massa molar do lactato de cálcio anidro = 218 g · mol-1
Massa molar da água = 18 g · mol-1
A partir dos dados do texto, é possível determinar a massa de água eliminada pelo aquecimento:
mH2O = massa de lactato de cálcio hidratado - massa de lactato de cálcio anidro
mH2O = 30,8 g - 21,8 g
mH2O = 9 g
Segundo o texto, o aquecimento transforma o lactato de cálcio hidratado na sua forma anidra, conforme a reação abaixo:
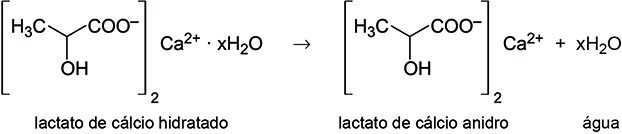
A partir da reação, temos a seguinte relação:
1 mol do lactato de cálcio anidro -------------- x mol de H2O
218 g de lactato de cálcio anidro -------------- x · 18 g de H2O
21,8 g -------------- 9 g
Aplicando a regra de três, temos:
x =
x = 5