Em um experimento de calorimetria realizado no nível do mar, um estudante colocou 600 g de água a 10 ºC e 100 g de gelo a –40 ºC em um calorímetro ideal, onde já existiam 800 g de água a 5 ºC, em equilíbrio térmico com o calorímetro.
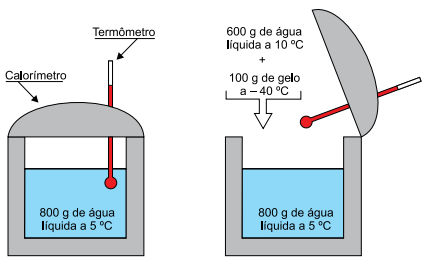
Sabendo que o calor específico da água líquida é 1 cal/(g·ºC), que o calor específico do gelo é 0,5 cal/(g·ºC) e que o calor latente de fusão do gelo é 80 cal/g, depois de atingido o novo equilíbrio térmico havia, dentro do calorímetro,
Inicialmente, pode-se determinar a quantidade de energia necessária para derreter todo o gelo:
Em seguida, é possível calcular a energia máxima liberada pelos 600 g de água a 10 °C:
Além disso, pode-se também determinar a energia máxima liberada pelos 800 g de água a 5 °C:
Sendo assim, ao se fazer as comparações dos calores calculados, pode-se concluir que os 600 g de água a 10 °C e os 800 g de água a 5 °C são capazes de fornecer a mesma quantidade de calor necessária para que todo o gelo seja derretido (10 000 cal).
Desse modo, pode-se concluir que, no equilíbrio térmico, temos 1 500 g de água líquida a 0 °C.