A tabela mostra os valores aproximados de pH de diferentes soluções aquosas, todas com a mesma concentração de 0,1 mol/L e a 25 ºC.
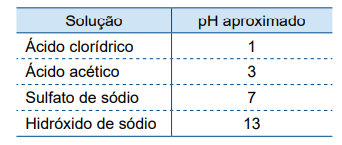
A solução que deve apresentar maior concentração total de íons e a solução que deve apresentar maior concentração de íons H+(aq) são, respectivamente, as soluções de
Ácido clorídrico
- ácido forte (100% ionizado)
Concentração de íons = 0,2 mol/L
Concentração de H+ -
Ácido acético
- ácido fraco
Concentração de H+-
Concentração de íons = 2 · 10-3 mol/L
Sulfato de sódio
- composto iônico 100% dissociado
Concentração de íons = 0,3 mol/L
Concentração de H+ -
Hidróxido de sódio
- base forte (100% dissociada)
Concentração de íons = 0,2 mol/L
Concentração de H+ -
Dentre as soluções apresentadas, a de sulfato de sódio apresenta maior concentração de íons, e a de ácido clorídrico, maior concentração de H+.