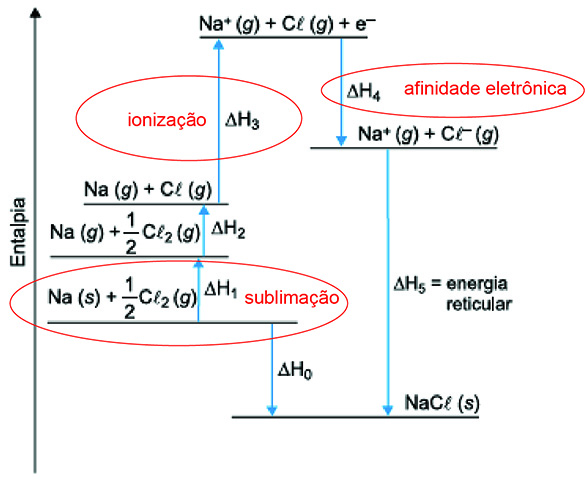
A variação de entalpia, associada à formação de um cristal iônico sólido a partir de seus íons no estado gasoso, é conhecida como energia reticular. Essa energia é difícil de ser medida diretamente, mas pode ser calculada de forma indireta, utilizando-se a Lei de Hess, a partir de outras transformações, cuja variação de entalpia é conhecida. Esse caminho para a determinação da energia reticular é conhecido como ciclo de Born-Haber. O diagrama a seguir mostra as etapas desse ciclo para o cloreto de sódio (NaCℓ).
Ciclo de Born-Haber para o cloreto de sódio
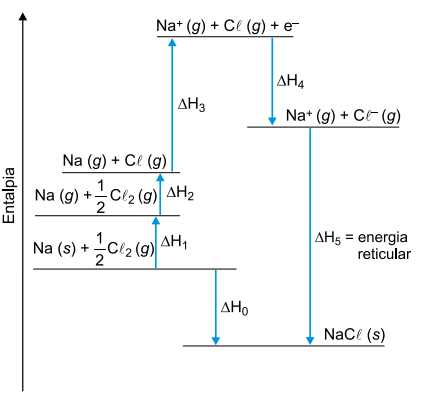
Nesse diagrama, a sublimação do sódio metálico, a primeira energia de ionização do elemento sódio e a afinidade eletrônica do elemento cloro correspondem, respectivamente, aos valores de
A sublimação do sódio metálico é a passagem do sódio sólido para o sódio no estado gasoso, sendo representada por:
A primeira energia de ionização corresponde à energia absorvida para a remoção do elétron da sua camada de valência do átomo de sódio gasoso.
A afinidade eletrônica do cloro é a energia liberada na captura de um elétron pelo átomo cloro gasoso.
Ciclo de Born-Haber para o cloreto de sódio