Leia o texto para responder a questão.
Um dispositivo que converte energia química em energia elétrica e opera com alimentação contínua dos reagentes que participam das reações no ânodo e no cátodo é denominado célula a combustível. Um esquema desse dispositivo é apresentado na figura.
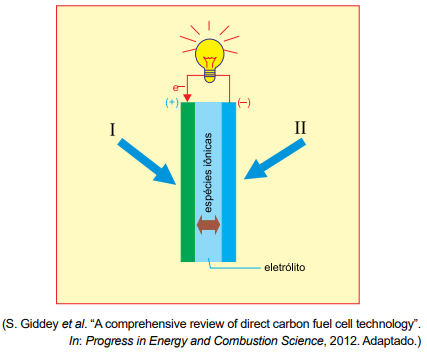
Utilizando-se metanol e oxigênio do ar atmosférico na alimentação desse dispositivo, a reação global que se processa é:
CH3OH (ℓ) + 3/2 O2 (g) → CO2 (g) + 2H2O (ℓ) ΔHºreação = –727kJ/mol.
O reagente I que participa da reação que ocorre no eletrodo positivo e a quantidade de elétrons envolvidos na formação de 1 mol de CO2 são
Pelo desenho fornecido, o elemento I está no polo positivo da célula de combustível, ou seja, ele deve sofrer redução. Analisando-se a equação global:
Variação do Nox:
- Elemento oxigênio sofre redução, pois seu número de oxidação varia de 0 no gás oxigênio para -2 nos produtos oxigenados da reação.
Como em I ocorre uma redução, conclui-se que o O2 deve alimentar esse eletrodo do circuito.
- Elemento carbono sofre oxidação, pois seu número de oxidação varia de -2 no metanol para +4 no dióxido de carbono, ou seja, para a formação de 1 mol de CO2 a partir do metanol são doados 6 mol de elétrons, o que corresponde à variação do Nox do carbono.