Na indústria química moderna, a economia percentual de átomos tem uma forte componente ambiental, sendo, inclusive, um aspecto muito mais importante que o rendimento percentual, que tem uma componente mais econômica. A hidrazina (N2H4), um poderoso combustível para foguetes, pode ser obtida por diferentes reações de síntese, duas das quais estão representadas pelas equações químicas abaixo:
2 NH3 + H2O2 → N2H4 + 2 H2O (1)
2 NH3 + OCl- → N2H4 + H2O + Cl- (2)
a) Imagine que você deve orientar a cúpula administrativa de uma indústria a utilizar uma dessas duas sínteses. Com base na maior economia percentual de átomos, qual seria a sua sugestão? Mostre que sua sugestão é a melhor opção.
b) Considere que, numa síntese de hidrazina, partindo-se de 2 mols de amônia e excesso do outro reagente, tenham sido obtidos 14 g de hidrazina. Considerando-se que o rendimento percentual da reação, nesse caso, foi maior que a economia percentual de átomos, qual processo de síntese foi utilizado, o 1 ou o 2? Justifique.
Dados:
economia percentual de átomos = {(massa do produto desejado) / (massa de todos os reagentes)} x 100, levando-se em conta apenas a estequiometria da reação;
rendimento percentual da reação = {(massa obtida do produto desejado) / (massa teórica esperada do produto desejado)} x 100.
a) Reação 1: 2 NH3 + H2O2 → N2H4 + 2 H2O
estequiometria: 2 · 17 g 34 g 32 g
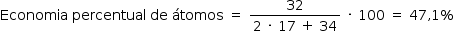
Reação 2: 2 NH3 + OCℓ– → N2H4 + H2O + Cℓ–
estequiometria: 2 · 17 g 51,5 g 32g
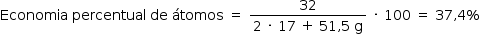
A melhor opção é a reação 1.
b) Cálculo da massa teórica esperada do produto desejado:
2 mol NH3_____ 1 mol N2H4
2 mol NH3_____ 1 · 32g N2H4
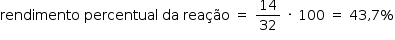
O processo de síntese utilizado é o 2.