A natureza fornece não apenas os insumos como também os subsídios necessários para transformá- los, de acordo com as necessidades do homem. Um exemplo disso é o couro de alguns peixes, utilizado para a fabricação de calçados e bolsas, que pode ser tingido com corantes naturais, como o extraído do crajiru, uma planta arbustiva que contém o pigmento natural mostrado nos equilíbrios apresentados a seguir. Esse pigmento tem a característica de mudar de cor de acordo com o pH. Em pH baixo, ele tem a coloração vermelha intensa, que passa a violeta à medida que o pH aumenta.
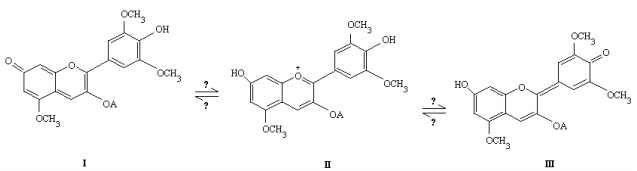
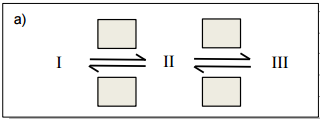
a) Complete o desenho no espaço de resolução, preenchendo os retângulos vazios com os símbolos H+ ou OH- , de modo a contemplar os aspectos de equilíbrio ácido-base em meio aquoso, de acordo com as informações químicas contidas na figura acima.
b) Dentre as espécies I, II e III, identifique aquela(s) presente(s) no pigmento com coloração violeta e justifique sua escolha em termos de equilíbrio químico.
a) Em soluções ácidas, ou seja, de pH baixo, o excesso de H+ irá protonar o grupo carbonila das estruturas I e III, transformando-as na estrutura catiônica II. Desse modo, tem-se:
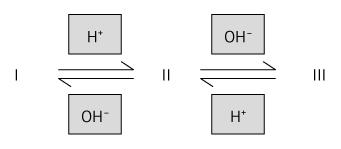
b) De acordo com o texto, o corante assume a coloração violeta à medida que o pH aumenta, ou seja, aumenta a concentração de OH–.
Pelo esquema do item anterior, conclui-se então que as espécies I e III são as que apresentam a coloração violeta, visto que o aumento na concentração de hidroxila desloca o equilíbrio formando esses compostos.