A oxidação de SO2 a SO3 é uma das etapas da produção de ácido sulfúrico.
![]()
Em uma indústria, diversas condições para essa oxidação foram testadas. A tabela a seguir reúne dados de diferentes testes:

a) Em qual dos quatro testes houve maior rendimento na produção de SO3? Explique.
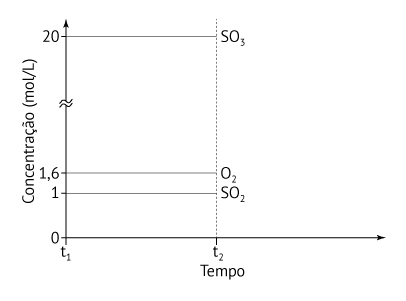
b) Em um dado instante t1, foram medidas as concentrações de SO2, O2 e SO3 em um reator fechado, a 1000 ºC, obtendo-se os valores: [SO2] = 1,0 mol/L; [O2] = 1,6 mol/L; [SO3] = 20 mol/L. Considerando esses valores, como é possível saber se o sistema está ou não em equilíbrio? No gráfico abaixo, represente o comportamento das concentrações dessas substâncias no intervalo de tempo entre t1 e t2, considerando que, em t2, o sistema está em equilíbrio químico.

a) Como a reação é exotérmica e ocorre com contração volumétrica, o equilíbrio se estabelecerá com maior rendimento, ou seja, com maior concentração de produto no equilíbrio, quando for realizado a 400 ºC (menor temperatura) e a 500 atm (maior pressão), portanto no teste 1. Além disso, o excesso de O2 tende a fazer com que o SO2 tenha um alto grau de conversão em SO3 nesse teste.
b) 2 SO2(g) + 1 O2(g) ⇆ 2 SO3(g)
![«math style=¨font-family:Tahoma¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mrow»«msub»«mi mathvariant=¨normal¨»K«/mi»«mi mathvariant=¨normal¨»c«/mi»«/msub»«mo»§#x000A0;«/mo»«mo»=«/mo»«mo»§#x000A0;«/mo»«mfrac»«mrow»«mo»[«/mo»«msub»«mi»SO«/mi»«mn»3«/mn»«/msub»«msup»«mo»]«/mo»«mn»2«/mn»«/msup»«/mrow»«mrow»«mo»[«/mo»«msub»«mi»SO«/mi»«mn»2«/mn»«/msub»«msup»«mo»]«/mo»«mn»2«/mn»«/msup»«mo»§#x000A0;«/mo»«mo»§#x000B7;«/mo»«mo»§#x000A0;«/mo»«mo»[«/mo»«msub»«mi mathvariant=¨normal¨»O«/mi»«mn»2«/mn»«/msub»«mo»]«/mo»«/mrow»«/mfrac»«mo»§#x000A0;«/mo»«mo»=«/mo»«mo»§#x000A0;«/mo»«mn»250«/mn»«mo»§#x000A0;«/mo»«mo»(«/mo»«mi mathvariant=¨normal¨»a«/mi»«mo»§#x000A0;«/mo»«mn»1000«/mn»«mo»§#x000A0;«/mo»«mo»§#x000B0;«/mo»«mi mathvariant=¨normal¨»C«/mi»«mo»)«/mo»«/mrow»«/mstyle»«/math»](https://anglo.plurall.net/sites/all/libraries/ckeditor//plugins/ckeditor_wiris/integration/showimage.php?formula=357f91fb288feec35035c052ad2b252b.png)
Em t1 tem-se: [SO2] = 1 mol/L; [O2] = 1,6 mol/L; [SO3] = 20 mol/L
Calculando-se o quociente vem:
![«math style=¨font-family:Tahoma¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mrow»«msub»«mi mathvariant=¨normal¨»Q«/mi»«mi mathvariant=¨normal¨»c«/mi»«/msub»«mo»§#x000A0;«/mo»«mo»=«/mo»«mo»§#x000A0;«/mo»«mfrac»«mrow»«mo»[«/mo»«msub»«mi»SO«/mi»«mn»3«/mn»«/msub»«msup»«mo»]«/mo»«mn»2«/mn»«/msup»«/mrow»«mrow»«mo»[«/mo»«msub»«mi»SO«/mi»«mn»2«/mn»«/msub»«msup»«mo»]«/mo»«mn»2«/mn»«/msup»«mo»§#x000A0;«/mo»«mo»§#x000B7;«/mo»«mo»§#x000A0;«/mo»«mo»[«/mo»«msub»«mi mathvariant=¨normal¨»O«/mi»«mn»2«/mn»«/msub»«mo»]«/mo»«/mrow»«/mfrac»«mo»§#x000A0;«/mo»«mo»=«/mo»«mo»§#x000A0;«/mo»«mfrac»«mrow»«mo»(«/mo»«mn»20«/mn»«msup»«mo»)«/mo»«mn»2«/mn»«/msup»«/mrow»«mrow»«mo»(«/mo»«mn»1«/mn»«mo»)«/mo»«mo»§#x000A0;«/mo»«mo»§#x000B7;«/mo»«mo»§#x000A0;«/mo»«mo»(«/mo»«mn»1«/mn»«mo»,«/mo»«mn»6«/mn»«mo»)«/mo»«/mrow»«/mfrac»«mo»§#x000A0;«/mo»«mo»=«/mo»«mo»§#x000A0;«/mo»«mfrac»«mn»400«/mn»«mrow»«mn»1«/mn»«mo»,«/mo»«mn»6«/mn»«/mrow»«/mfrac»«mo»§#x000A0;«/mo»«mo»=«/mo»«mo»§#x000A0;«/mo»«mn»250«/mn»«/mrow»«/mstyle»«/math»](https://anglo.plurall.net/sites/all/libraries/ckeditor//plugins/ckeditor_wiris/integration/showimage.php?formula=0c400fe4fb7e41a3ebe8f9e1b733bebf.png) ,
,
ou seja, o sistema já se encontra em equilíbrio em t1, e portanto as concentrações não irão variar a partir desse instante.
O gráfico será: