Leia o texto para responder à questão.
Em um laboratório, uma estudante sintetizou sulfato de ferro(II) hepta-hidratado (FeSO4 ·7H2O) a partir de ferro metálico e ácido sulfúrico diluído em água. Para tanto, a estudante pesou, em um béquer, 14,29 g de ferro metálico de pureza 98,00%. Adicionou água destilada e depois, lentamente, adicionou excesso de ácido sulfúrico concentrado sob agitação. No final do processo, a estudante pesou os cristais de produto formados.
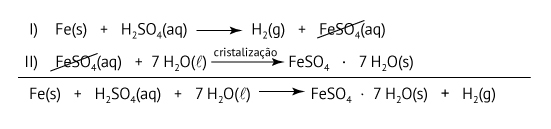
Para a síntese do sulfato de ferro(II) hepta-hidratado, após a reação entre ferro metálico e ácido sulfúrico, a estudante deixou o béquer resfriar em banho de gelo, até a cristalização do sal hidratado. A seguir, a estudante separou o sólido por filtração, o qual, após ser devidamente lavado e secado, apresentou massa igual a 52,13 g. Dadas as massas molares (g·mol–1): Fe = 56,0; S = 32,0; H = 1,0; O = 16,0, escreva a equação balanceada da reação global de formação do sulfato de ferro(II) hepta-hidratado sintetizado pela estudante e calcule o rendimento da reação a partir do ferro metálico e do ácido sulfúrico.
massa de ferro puro = 98% de 14,29 g = 14 g
massa de FeSO4 · 7 H2O(s) produzida = 52,13 g
Fe(s) + H2SO4(aq) + 7 H2O(ℓ)  FeSO4 · 7 H2O(s) + H2(g)
FeSO4 · 7 H2O(s) + H2(g)
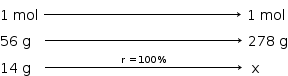
x = 69,5 g se o rendimento fosse de 100%
r = 100% ________ 69,5 g
y ________ 52,13 g
y = 75%