Um dirigível experimental usa hélio como fluido ascensional e octano (C8H18) como combustível em seu motor, para propulsão. Suponha que, no motor, ocorra a combustão completa do octano:
![]()
Para compensar a perda de massa do dirigível à medida que o combustível é queimado, parte da água contida nos gases de exaustão do motor é condensada e armazenada como lastro. O restante do vapor de água e o gás carbônico são liberados para a atmosfera.
Qual é a porcentagem aproximada da massa de vapor de água formado que deve ser retida para que a massa de combustível queimado seja compensada?
Note e adote:
Massa molar (g/mol):
H2O ...... 18
O2 ............. 32
CO2 ....... 44
C8H18 ...... 114
A equação de combustão do octano é representada abaixo:
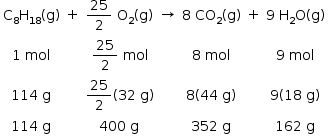
Como são formados 162 g de H2O na combustão de 114 g de C8H18, será necessário reter 114 g de H2O para repor a massa do octano queimado.
162 g H2O (produzido) –––––––– 100%
114 g H2O (retido) –––––––– x
x = 70,37%