O diagrama ao lado representa algumas espécies que podem ser formadas quando o Fe metálico é exposto a diferentes condições de pH e potencial de redução medidos contra o eletrodo padrão de hidrogênio. As regiões relativas às espécies Fe(OH)2 e FeO42- estão associadas às regiões marcadas como (I) e (II) no diagrama, não necessariamente nessa ordem.
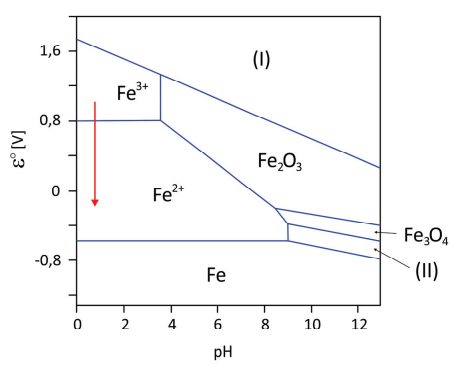
a) Para evitar a corrosão de um objeto de ferro metálico, este foi submetido a pH e potencial adequados, formando uma camada de Fe3O4 na superfície. Explique como essa camada previne a corrosão do interior do objeto.
b) Escreva a semirreação de redução associada ao processo representado pela seta, indicando o valor de potencial a partir do qual a reação acontece.
c) Associe, corretamente, na tabela da folha de resposta, cada uma das regiões (I) e (II) com as espécies Fe(OH)2 e FeO42-. Justifique a associação feita com base nos potenciais de redução apresentados no diagrama.
a) O Fe3O4 é um óxido misto formado por uma composição entre o óxido de ferro II (FeO) e óxido de ferro III (Fe2O3). Desse modo, a camada de Fe3O4 já apresenta a espécie ferro em sua forma oxidada (Fe2+ e Fe3+), o que, combinado ao oxigênio, promove a passivação do ferro, prevenindo a corrosão do ferro metálico presente no interior da estrutura.
b)
c) Região I –
Região II – Fe(OH)2
A partir da análise do diagrama apresentado, pode-se observar que há uma tendência de aumento dos potenciais padrão de redução, à medida que se tem formas do ferro com maior número de oxidação. Desse modo, pode-se associar a espécie química (Nox (Fe) = + 6) com a região I, e a espécie Fe(OH)2 (Nox (Fe) = + 2) com a região II.