O gás N2 é relevante para diversos processos tecnológicos e industriais por ser considerado um gás inerte e, portanto, ser utilizado para evitar contato do processo com espécies reativas presentes na atmosfera. Uma das características que faz o N2 ser inerte é a força de ligação entre átomos de N.
O N2 utilizado comercialmente costuma ser obtido por separação do ar atmosférico, composto majoritariamente por N2, O2, CO2, Hélio e Argônio.
a) No preparo de uma amostra de N2 para uso industrial, quatro misturas de gases foram obtidas, conforme apresentado na tabela. Qual ou quais dessas misturas seria(m) adequada(s) para processos que não podem ser realizados na presença de gases oxidantes?

b) Desenhe as estruturas de Lewis para N2 e O2 e explique, com base nessas estruturas, por que a ligação entre os átomos de N no N2 é mais forte do que a ligação entre átomos de O no O2.
Uma forma de obter um fluxo de nitrogênio gasoso de grande pureza é por meio da evaporação do nitrogênio líquido armazenado no interior de um botijão criogênico. Considere que um botijão como esse foi preenchido com 70 L de nitrogênio líquido que, quando evaporado, pode ser retirado como nitrogênio gasoso do cilindro.
c) Calcule, em L, o volume de nitrogênio gasoso que pode ser coletado à temperatura de 30 °C e pressão ambiente de 1 atm, a partir desse botijão. Considere que todo líquido pode ser aproveitado e que não houve perdas.
Note e adote:
Densidade do nitrogênio líquido: 0,8 g/mL
Volume molar de gás ideal a 1 atm e 30 °C: 25 L
Massa molar (g/mol): N2 = 28
Distribuição eletrônica N: 1s2, 2s2, 2p3; O: 1s2, 2s2, 2p4
a) As misturas 2 e 3 seriam adequadas, pois os gases presentes não são oxidantes. As misturas 1 e 4 possuem O2, que é um gás oxidante.
b) Fórmula eletrônica do N2:

Fórmula eletrônica do O2:
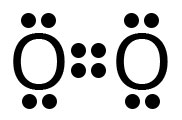
Entre os átomos de nitrogênio, temos uma ligação tripla, e entre os átomos de oxigênio, ligação dupla. A ligação tripla é mais forte, logo a ligação entre os átomos de nitrogênio é mais forte do que entre os átomos de oxigênio.
c) Cálculo da massa de nitrogênio no estado líquido:
No estado gasoso, a massa de nitrogênio também será de 56000 g.
Como a massa molar do nitrogênio é 28 g/mol e o volume molar, 25 L/mol: