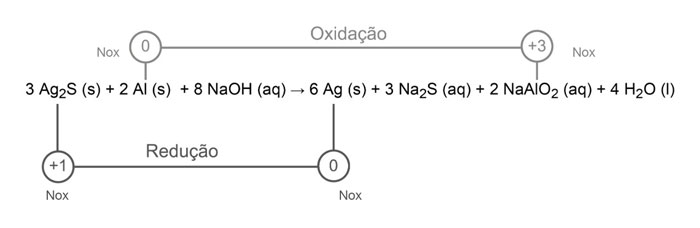
Os objetos de prata tendem a escurecer com o tempo, em contato com compostos de enxofre, por causa da formação de uma película superficial de sulfeto de prata (Ag2S), que é escuro. Um método muito simples para restaurar a superfície original desses objetos é mergulhá-los em uma solução diluída aquecida de hidróxido de sódio (NaOH), contida em uma panela comum de alumínio. A equação química que ilustra esse processo é:
3 Ag2S (s) + 2 Al (s) + 8 NaOH (aq) → 6 Ag (s) + 3 Na2S (aq) + 2 NaAlO2 (aq) + 4 H2O (l)
A restauração do objeto de prata ocorre por causa do(a)
No processo de restauração da prata ocorre redução de Ag+ (Nox = +1) para Ag0 (Nox =0). A espécie química que atua como agente redutor (provoca redução/sofre oxidação) no processo é o alumínio, cujo número de oxidação varia de 0 até + 3, como indicado na equação representativa abaixo: