Para estudar equilibrio químico de íons Co2+ em solução, uma turma de estudantes realizou uma série de experimentos explorando a seguinte reação:
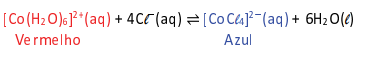
Nesse equilibrio, o composto de cobalto com água, (Co(H2O)6]2+(aq), apresenta coloração vermelha, enquanto o composto com cloretos, [CoCℓ4]2-(aq), possui coloração azul. Para verificar o efeito de ânions de diferentes sais nessa mudança de cor, 7 ensaios diferentes foram realizados. Aos tubos contendo apenas alguns mL de uma solução de nitrato de cobalto II, de coloração vermelha, foram adicionadas pequenas quantidades de diferentes sais em cada tubo, como apresentado na tabela, com exceção do ensaio 1, no qual nenhum sal foi adicionado.
Após agitação, os tubos foram deixados em repouso por um tempo, e a cor final foi observada.
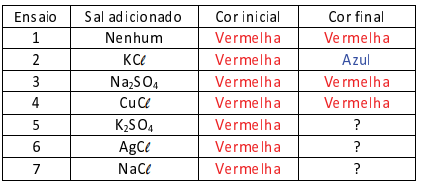
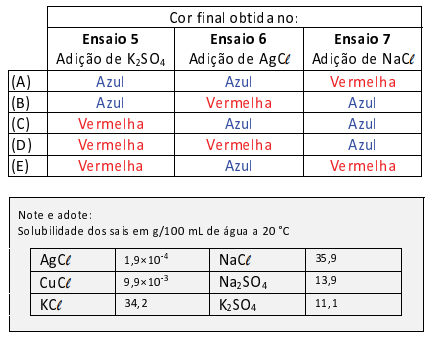
A alternativa que representa a cor final observada nos ensaios 5,6 e 7, respectivamente, é :
A questão cobrava pelo feito de ânions de diferentes sais na coloração de uma solução aquosa de nitrato de cobalto, que apresentava coloração vermelha.
Pela análise do equilíbrio apresentado a seguir:
A adição de sais solúveis, que apresentam em sua fórmula o ânion cloreto (Cℓ-), deslocará o equilíbrio para a direita e a solução irá adquirir a coloração azul.
Analisando os sais adicionados:
- Ensaio 5 - Adição de K2SO4
A sua dissociação, em água, pode ser representada pela equação:
Como não existe nenhum ânion comum no equilíbrio, a sua coloração permanecerá a mesma, vermelha.
- Ensaio 6 - AgCℓ
A adição do AgCℓ (solubilidade, em gramas, do sal em 100 g água = 1,9 · 10-4), que é muito pouco solúvel, não irá alterar de maneira significativa a concentração de ânions cloreto na solução; com isso, a coloração da solução inicial permanecerá vermelha.
- Ensaio 7 - NaCℓ
A sua dissociação, em água, pode ser representada pela equação:
Nesse caso, ocorrerá uma aumento na concentração de ânions cloreto (Cℓ- ), deslocando o equilíbrio para a direita e a solução irá adquirir coloração azul.