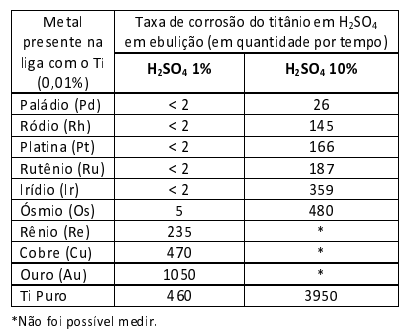
Um experimento expôs uma barra de titânio (TI) pura e ligas desse material com 0,01% de diferentes metais nobres a soluções de ácido sulfúrico em ebulição para entender o efeito anticorrosivo desses metais no titânio. O resultado é mostrado na tabela a seguir:
Com base nessas informações, é correto afirmar:
a) Incorreta – A solução ácida mais concentrada aumentou a taxa de corrosão do titânio com Pd, Rh e Pt.
b) Incorreta – Espera-se que a solução ácida mais concentrada aumente a taxa de corrosão (diminuindo o tempo de reação) para o titânio com Re, Cu e Au. Por isso não foi possível medir.
c) Incorreta – Quanto maior a taxa de corrosão, menor será o potencial anticorrosivo do metal. Sendo assim, a escala de potencial será Pd > Rh > Pt > Ru > Ir > Os > Re > Cu > Au.
d) Correta – Os metais Pd, Rh e Pt apresentaram melhores resultados com anticorrosivos, pois exibiram menores taxas de corrosão. Diferente do Cu e Au, que mostraram os piores resultados.
e) Incorreta – A adição de alguns metais melhorou a resistência do titânio puro.