Leia o texto para responder às questão.
Dependendo das condições reacionais, monóxido de nitrogênio e monóxido de carbono reagem para formar dióxido de carbono e gás nitrogênio, ou monóxido de dinitrogênio, conforme representado nas equações a seguir.
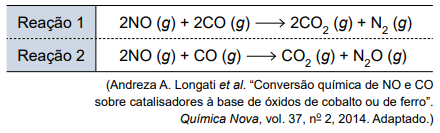
Comparando-se separadamente os gases que estão envolvidos nas reações 1 e 2, pode-se afirmar que, sob as mesmas condições de temperatura e pressão, esses cinco gases
Os cinco gases envolvidos nas reações são:
CO: massa molar = 28 g/mol
N2: massa molar = 28 g/mol
NO: massa molar = 40 g/mol
CO2: massa molar = 44 g/mol
N2O: massa molar = 44 g/mol
A densidade dos gases pode ser calculada por meio da equação de estado.
Essa equação mostra que, nas mesmas condições de pressão e temperatura, a densidade dos gases dependerá apenas de suas massas molares. Dessa forma teremos:
Ou seja, esses cinco gases podem ser organizados em três conjuntos de densidades.