Arla 32 é uma solução de aproximadamente 32 g de ureia (H2NCONH2) em 100 mL de água utilizada em veículos a diesel para diminuir as emissões de óxidos de nitrogênio (NO e NO2), que podem causar problemas ambientais quando em excesso na atmosfera. A solução de Arla, ao ser adicionada aos gases de escape do motor, em alta temperatura, forma amônia (reação I). Em uma segunda etapa, a amônia formada reage com NO2 e gera gás nitrogênio e água (reação II).
(I) H2NCONH2(aq) + H2O(ℓ) → 2NH3(g) + CO2(g)
(II) 8NH3(g) + 6NO2(g) → 7N2(g) + 12H2O(g)
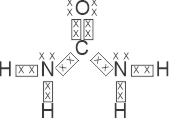
a) Escreva a fórmula de Lewis da ureia.
b) Calcule quantos litros de solução de Arla 32 são necessários para consumir todo o NO2 produzido em uma viagem de 100 km, considerando que a quantidade de NO2 formado por esse veículo é de 460 mg por km rodado. Indique os cálculos.
c) Considerando que a reação entre NH3 e NO forma os mesmos produtos que a reação II, o volume gasto de Arla 32 para consumir o NO seria menor, igual ou maior ao usado para consumir uma mesma quantidade em mol de NO2? Justifique mostrando a reação entre NH3 e NO.
Note e adote:
Considerar todas as reações com 100% de rendimento.
Massas molares: ureia = 60 g.mol‐1; NO2 = 46 g.mol‐1
Distribuição eletrônica: H: 1s1; C: 1s2 2s2 2p2; N: 1s2 2s2 2p3; O: 1s2 2s2 2p4
a) Fórmula de Lewis:
b) Quantidade de NO2 produzido na viagem:
A equação que relaciona ureia e NO2 pode ser obtida multiplicando-se a equação (I) por 4 e somando-se as duas equações:
Volume de Arla 32
c) A equação que relaciona ureia e NO é:
Volume de Arla
O volume de Arla consumido será menor.