O leite de magnésia é uma suspensão aquosa. Determinada embalagem desse produto mostra a seguinte composição:
Cada 15 mL contém: hidróxido de magnésio (1282,50 mg), hipoclorito de sódio e água purificada.
Um grupo de estudantes resolveu utilizar uma amostra desse leite de magnésia, que se encontrava com data de validade expirada para ingestão humana, a fim de obter sulfato de magnésio hepta-hidratado, a ser utilizado em laboratório escolar como reagente para testes qualitativos. Para tanto, executaram o procedimento ilustrado a seguir.
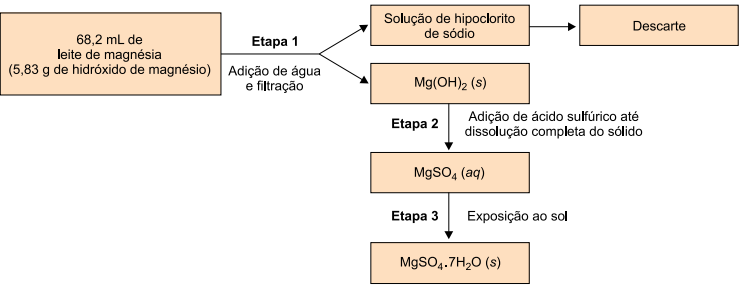
a) Represente, por meio de fórmula, as ligações químicas presentes no hidróxido de magnésio, Mg(OH)2. Cite o nome do método de separação de misturas empregado pelos estudantes na última etapa do procedimento.
b) Escreva a equação da reação química que ocorre na etapa 2. Calcule a massa de sulfato de magnésio hepta-hidratado obtida pelos estudantes, admitindo que o rendimento foi de 100%.
a) Ligações químicas presentes no Mg(OH)2
Ligação iônica entre o átomo de magnésio e o grupo hidróxido.
Ligação covalente entre os átomos de oxigênio e hidrogênio.
Na última etapa do processo (etapa 3), a solução aquosa de MgSO4 foi exposta ao sol, então, com a evaporação da água, sobrou MgSO4.7H2O sólido.
b) Reação química que ocorre na etapa 2:
Cálculo do número de mol de sulfato de magnésio obtido a partir de 5,83 g de hidróxido de magnésio:
Massa molar do Mg(OH)2 = 58,3 g/mol
Cálculo da massa de sulfato de magnésio hepta-hidratado:
Massa molar do MgSO4.7H2O = 246,3 g/mol