Considere um cubo de aço inoxidável cujas arestas medem 1 cm.
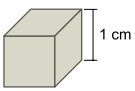
Deseja-se recobrir as faces desse cubo com uma camada uniforme de cobre de 1 × 10–2 cm de espessura. Para isso, o cubo pode ser utilizado como cátodo de uma cuba eletrolítica contendo íons Cu2+(aq). Admita que a eletrólise se realize sob corrente elétrica de 200 mA, que a constante de Faraday seja igual a 1 × 105 C/mol e que a densidade do cobre seja 9 g/cm3. Assim, estima-se que o tempo de eletrólise necessário para que se deposite no cubo a camada de cobre desejada será próximo de
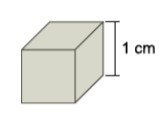
O cubo apresentado possui 6 faces que devem ser recobertas, numa área total de 6 cm2. Para que a espessura do recobrimento de cada face seja de 1 · 10-2 cm, o volume total do depósito de cobre deve ser:
V = A·h = 6 cm2·1·10-2 cm = 6·10-2 cm3
Como a densidade do cobre é igual a 9 g/cm3, tem-se: