Leia o texto para responder à questão
O corante índigo é uma das substâncias mais antigas utilizadas para colorir tecidos de celulose, como as calças jeans. É uma molécula insolúvel em água, que precisa ser solubilizada para poder grudar no tecido e depois precipitada para não sair quando o tecido for lavado. Sua solubilização ocorre pela reação entre o índigo e uma mistura de hidróxido de sódio (NaOH) e ditionito de sódio (Na2 S2 O4 ), que forma o leucoíndigo, solúvel em água. A equação a seguir representa essa reação.
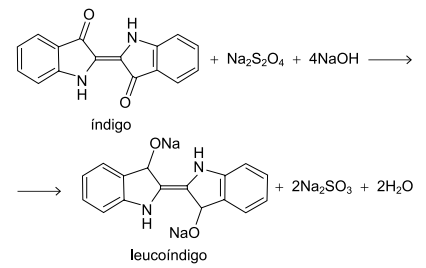
A indústria têxtil gera muitos efluentes contaminados com o leucoíndigo. Essa substância pode ser removida da solução resultante por eletrólise, recuperando o índigo insolúvel.
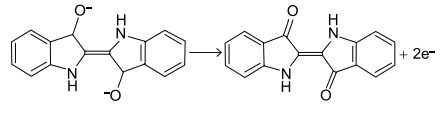
Um efluente foi eletrolisado durante 5 horas, 21 minutos e 40 segundos, utilizando-se uma corrente elétrica de intensidade 0,1 ampère. Considerando a constante de Faraday igual a 96500 C/mol, a quantidade de matéria de índigo precipitada nesse intervalo de tempo e o eletrodo em que ocorre a reação são
O tempo da eletrólise em segundos é:
5h = 18000s
21 minutos = 1260s
18000 + 1260 + 40 = 19300s
A carga de elétrons (Q) que participa da eletrólise é:
Q = i.t
Q = 19300.01 = 1930C
A quantidade de índigo precipitada pode ser determinada pela equação de oxidação:
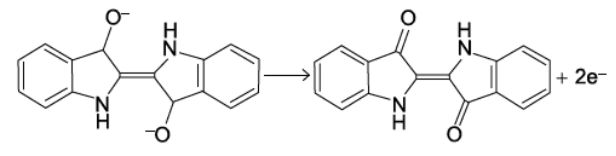
1mol 2mol
1mol ---------------------2.96500C
n ------------------------ 1930C
n = 0,01mol
Nessa eletrólise 0,01 mol de índigo é precipitado no anodo.