Entre as propriedades mais estudadas dos compostos orgânicos estão a capacidade de sofrer combustão, a solubilidade em água e a volatilidade. Considere as informações apresentadas a seguir.
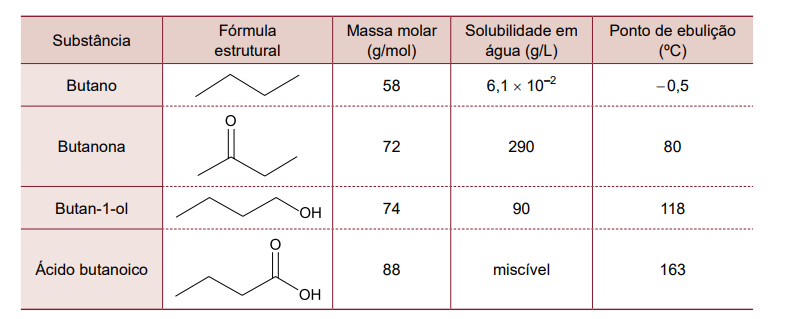
a) Qual das substâncias apresentadas na tabela é a mais polar? Determine a massa de butan-1-ol dissolvida em 250 mL de uma solução saturada dessa substância.
b) Equacione a reação de combustão completa do butan-1-ol. Explique por que o butan-1-ol apresenta maior ponto de ebulição que a butanona, apesar de suas massas molares serem muito próximas.
a) Entre as substâncias encontradas na tabela, o ácido butanoico é a mais polar.
A partir da solubilidade do butan-1-ol, a massa do álcool dissolvida é:
90g --------- 1000mL
m ---------- 250mL
m = 22,5g
b) A equação de combustão completa do butan-1-ol é:
C4H10O + 6O2 → 4CO2 + 5H2O
A temperatura de ebulição do butan-1-ol é maior do que a da butanona, pois as interações intermoleculares existentes entre as moléculas do butan-1-ol (interações do tipo ligação de hidrogênio) são mais intensas do que as entre as moléculas da butanona (do tipo dipolo-dipolo).