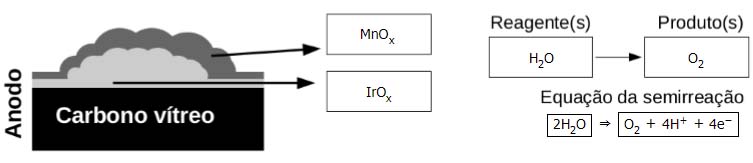
A reação de evolução de oxigênio (REO) e a reação de evolução de cloro (REC) são dois processos eletroquímicos de alta relevância na decomposição da água para a conversão da energia solar e na produção de insumos químicos, respectivamente. Realizar esses dois processos separadamente é um grande desafio quando se trata do uso de água do mar.
Assim começa o resumo de um estudo recente, em que pesquisadores investigaram a construção de um eletrodo para a eletrólise da água do mar em baixo valor de pH. Sabe-se que, nas condições avaliadas, o IrOx promove as duas reações (REO e REC) e é permeável a todas as espécies presentes na água do mar, ao passo que o MnOx não promove nenhuma das duas reações e é impermeável aos íons cloreto.
(Adaptado de The Journal of the American Chemical Society, v. 140, p. 10270-10281, 2018.)
a) Do ponto de vista químico, por que utilizar a água do mar seria um desafio? E por que vencer esse desafio seria útil à sociedade?
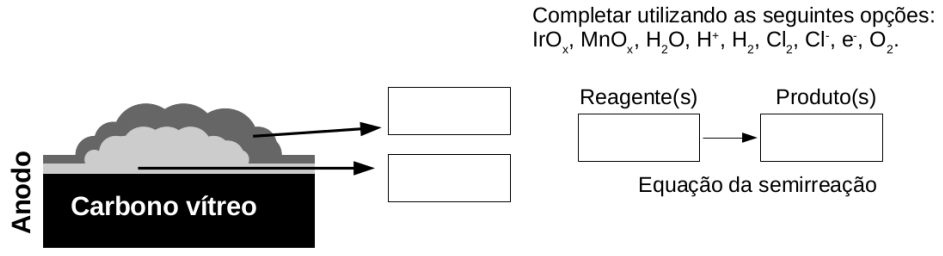
b) Os pesquisadores foram bem sucedidos no objetivo experimental ao empregar os dois óxidos na construção do anodo para a eletrólise da água do mar. Complete os espaços em branco da figura abaixo utilizando as opções fornecidas, de forma a ilustrar corretamente o resultado obtido nesse estudo.
a) O desafio ocorre pelo fato de, na água do mar, tanto o elemento oxigênio como o cloro estarem presentes, logo há a possibilidade da ocorrência da REO e da REC. Vencer esse desafio seria útil à sociedade, pois isso permitiria produzir isoladamente cada substância.
b) de acordo com enunciado, houve sucesso do objetivo proposto, ou seja, houve a produção de apenas uma substância. Para isso ocorrer, a parte externa do eletrodo deve ser permeável apenas um elemento, logo, deve ser revertido com MnOx para que o IrOx promova somente a REO, de acordo com o esquema.