De acordo com a teoria atômica de Dalton, os átomos eram considerados maciços e indestrutíveis, sendo preservados intactos nas transformações químicas. Além disso, o que diferenciava um elemento químico de outro era o peso de seus átomos. Em sua teoria, Dalton não admitia a união entre átomos de um único elemento químico. Átomos de elementos químicos diferentes poderiam se unir, formando o que Dalton denominava “átomos compostos”.
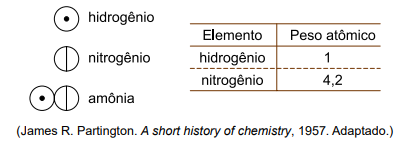
A imagem mostra os símbolos criados por Dalton para representar os elementos químicos hidrogênio e nitrogênio e a substância amônia. Ao lado, há uma tabela com os pesos atômicos relativos estimados por Dalton para esses dois elementos.
a) Escreva a equação da reação de formação da amônia a partir de hidrogênio e nitrogênio, de acordo com a teoria de Dalton. Escreva a equação dessa reação de acordo com os símbolos e conhecimentos atuais.
b) Calcule a razão entre os pesos de nitrogênio e de hidrogênio na amônia, tal como considerada por Dalton, e compare esse resultado com a razão entre as massas desses elementos na molécula de amônia, tal como conhecemos hoje. Admitindo como correta a razão calculada com base nos conhecimentos atuais, indique a diferença percentual, aproximadamente, entre as duas razões calculadas.
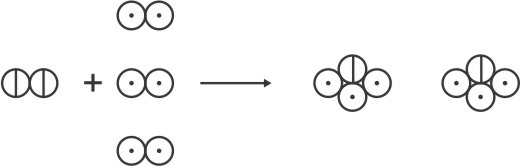
a) Pela teoria de Dalton, tem-se:
![]()
Modernamente, com os símbolos atuais, a síntese da amônia é dada pela equação:
Utilizando os símbolos propostos por Dalton combinados com os conhecimentos atuais sobre essa reação, tem-se:
b) Razão entre os pesos de nitrogênio e hidrogênio na amônia:
Por Dalton
Hoje
A diferença entre as razões é 4,66 – 4,2 = 0,46
A diferença percentual é