Em uma garrafa térmica, são colocados 200 g de água à temperatura de 30 ºC e uma pedra de gelo de 50 g, à temperatura de –10 ºC. Após o equilíbrio térmico,
Note e adote:
calor latente de fusão do gelo = 80 cal/g;
calor específico do gelo = 0,5 cal/g o C;
calor específico da água = 1,0 cal/g o C.
Para que o gelo derreta completamente, partindo da temperatura inicial de -10 ºC, tem-se:
Q = mcΔθ + mL = 50 · 0,5 [0 - ( - 10)] + 50 · 80
Q = 4250 cal
Por outro lado, a água, ao esfriar completamente até 0 ºC, pode perder:
Q = mcΔθ = 200 · 1 (0 - 30) = -6 000 cal
Dessa forma, a água não esfriará até 0 ºC, sendo a temperatura de equilíbrio θ > 0 ºC. Graficamente, tem-se:
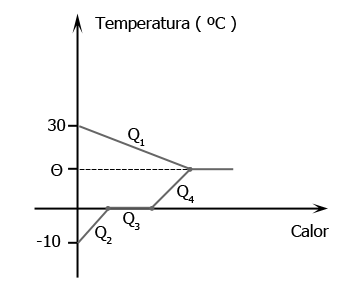
Como o sistema é termicamente isolado, tem-se:
Q1 + Q2 + Q3 + Q3 + Q4 = 0
200 · 1 (θ - 30) + 50 · 0,5 [0 - ( - 10)] + 50 · 80 + 50 · 1 (θ - 0) = 0
∴ θ = 7 ºC