As figuras representam dois modelos, 1 e 2, para o átomo de hidrogênio. No modelo 1, o elétron move-se em trajetória espiral, aproximando-se do núcleo atômico e emitindo energia continuamente, com frequência cada vez maior, uma vez que cargas elétricas aceleradas irradiam energia. Esse processo só termina quando o elétron se choca com o núcleo. No modelo 2, o elétron move-se inicialmente em determinada órbita circular estável e em movimento uniforme em relação ao núcleo, sem emitir radiação eletromagnética, apesar de apresentar aceleração centrípeta. Nesse modelo a emissão só ocorre, de forma descontínua, quando o elétron sofre transição de uma órbita mais distante do núcleo para outra mais próxima.
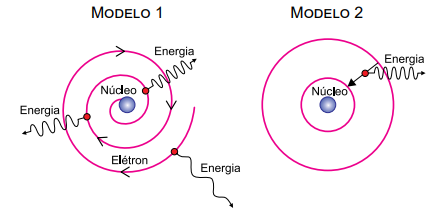
A respeito desses modelos atômicos, pode-se afirmar que
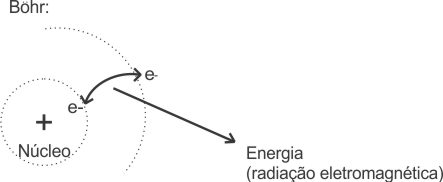
O Modelo 2 representa o processo de excitação eletrônica e posterior emissão de radiação de acordo com o modelo de Böhr: