A síntese do metano a partir da reação entre o gás monóxido de carbono e o gás hidrogênio é representada pelo equilíbrio químico:
![]()
Para avaliar as alterações no sistema que resultassem no aumento da produção de metano, o sistema em equilíbrio passou por quatro testes, indicados na tabela:

Resultaram no aumento da produção de metano no sistema apenas os testes de números
Alternativa A
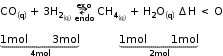
Teste 1
O aumento da temperatura desloca o
equilíbrio para a esquerda diminuindo
a produção de metano.
Teste 2
A diminuição da temperatura favorece
a reação exotérmica, deslocando o equilíbrio
para a direita, favorecendo a produção de metano.
Teste 3
A diminuição da pressas, desloca o equilíbrio
para a direita, lado de maior número
de mols, diminuindo a produção de metano.
Teste 4
A adição de gás hidrogênio desloca o
equilíbrio para a direita, favorecendo
a produção de metano.
Aumentam a produção de metano: 2 e 4