Em um experimento de laboratório, um grupo de alunos recebeu uma amostra de certo metal M para determinar o valor de sua massa, sem o uso de balança, a partir de dados fornecidos pelo professor e de um dado obtido pelo próprio grupo, no laboratório.
• Dado 1 – 13,95 g de outra amostra do mesmo metal M reagem com excesso de solução de ácido forte, produzindo 0,25 mol de gás hidrogênio, de acordo com a seguinte reação:
M (s) + 2H+ (aq) → M2+ (aq) + H2 (g)
• Dado 2 – O metal M corresponde a um dos cinco metais a seguir (com suas respectivas densidades): alumínio (2,7 g/cm3); chumbo (11,3 g/cm3); cobre (8,9 g/cm3); ferro (7,9 g/cm3); e zinco (7,1 g/cm3).
• Dado 3 – Determinação do volume da amostra recebida pelo grupo por meio da inserção da amostra em uma proveta com água, conforme representam as figuras.
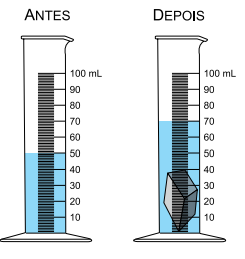
Alternativa D
Dado 1 m = 13,95g
1mol ___________________1mol
0,25mol____________________0,25mol
0,25mol____________________13,95g
1mol ___________________x
x = 55,8g massa molar do metal (ferro)
dfe = 7,9g/cm3 volume do metal = 20cm3
1cm3___________7,9g
20cm3___________x
x = 158g massa da amostra