Graças a sua alta conversão energética e à baixa geração de resíduos, o gás hidrogênio é considerado um excelente combustível. Sua obtenção a partir da fermentação anaeróbia de biomassas, como bagaço de cana, glicerol, madeira e resíduos do processamento da mandioca, abundantes e de baixo custo, parece ser uma boa alternativa tecnológica para o Brasil. A velocidade da fermentação, bem como os diferentes produtos formados e suas respectivas quantidades, dependem principalmente do tipo de substrato e do tipo de microrganismo que promove a fermentação. As equações e a figura abaixo ilustram aspectos de uma fermentação de 1 litro de solução de glicose efetuada pela bactéria Clostridium butyricum.
Equação 1: C6H12O6(aq) + 2H2O(ℓ) → 2CH3COOH(aq) + 4H2(g) + 2CO2(g)
Equação 2: C6H12O6(aq) + 2H2O(ℓ) → CH3CH2CH2COOH(aq) + 2H2(g) + 2CO2(g)
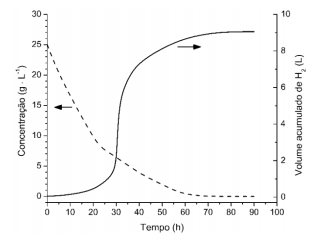
a) Levando em conta as informações presentes no texto e na figura, e considerando que a fermentação tenha ocorrido, concomitantemente, pelas duas reações indicadas, qual ácido estava presente em maior concentração (mol∙L-1) ao final da fermentação, o butanoico ou o etanoico? Justifique sua resposta.
b) A velocidade instantânea da fermentação, em qualquer ponto do processo, é dada pela relação entre a variação da quantidade de hidrogênio formado e a variação do tempo. De acordo com o gráfico, quanto tempo após o início da fermentação a velocidade atingiu seu valor máximo? Justifique sua resposta.
Dados: massa molar da glicose: 180 g∙mol-1; volume molar do hidrogênio: 25 L∙mol-1.
A concentração inicial desse substrato é 25 g/L. Convertendo isso para concentração em mol/L, teremos:
Percebe-se, pelo gráfico, que a quantidade máxima de H2 produzida é 9,0 L:

Como o volume molar do H2 nas condições de reação é dado como 25 L·mol-1, temos:
25 L de H2 ------------ 1 mol de H2
9 L de H2 -------------- n mol de H2
n = 0,36 mols de H2.
É necessário avaliar aqui o seguinte: essa quantidade de H2 produzida provém de duas reações químicas diferentes.
Da primeira reação, teremos:
1 mol de C6H12O6 ------------------ 4 mols de H2
x mol de C6H12O6 ------------------ 4·x mols de H2
Ou seja, para cada x mols de glicose que reage nessa reação, são formados 4·x mols de H2.
Para a segunda reação, teremos:
1 mol de C6H12O6 ------------------ 2 mols de H2
y mol de C6H12O6 ------------------ 2·y mols de H2
Ou seja, se considerarmos que reagem y mols de glicose nessa reação, então serão formados 2·y mols de H2
Assim, a quantidade total de H2 formada nada mais é que 4·x + 2·y, isto é, a soma do que foi formado nas duas reações. Já a quantidade total de glicose que reagiu nada mais é que x + y, isto é, a soma do que reagiu em cada reação.
É possível então, montar o seguinte sistema:
Ou seja, a soma das quantidades de H2 formadas em cada reação tem que dar os 0,36 mols produzidos (pelo gráfico). Já a soma das quantidades de glicose que reage deve ser igual a quantidade inicial de glicose no sistema (0,14 mol).
Resolvendo esse sistema, chega-se às seguintes respostas:
Ou seja, na primeira reação, 0,04 mol de glicose foram consumidos, enquanto na segunda reação, 0,10 mol de glicose foram consumidos.
Pode-se, por fim, montar uma relação de proporção para calcular quanto de cada ácido foi produzido em cada reação.
Na reação 1, teremos:
1 mol de C6H12O6 ------------------ 2 mols de ácido etanoico
0,04 mol de C6H12O6 ------------------ z mols de ácido etanoico
z = 0,08 mol de ácido etanoico.
Na reação 2, teremos:
1 mol de C6H12O6 ------------------ 1 mol de ácido butanoico
0,10 mol de C6H12O6 ------------------ w mol de ácido butanoico
w = 0,10 mol de ácido butanoico.
Por essa razão, teremos uma maior concentração de ácido butanoico no meio ao final da fermentação.
b) A velocidade instantânea da fermentação é máxima quando a curva de volume de H2 gerado versus tempo apresentar a maior inclinação, o que indica maior volume gerado num menor tempo. Isso ocorre, de acordo com o gráfico, após 30 horas do início da fermentação.