Apesar de ser um combustível alternativo em relação aos combustíveis fósseis, o gás hidrogênio apresenta alguns problemas em seu uso direto. Uma alternativa é produzir o gás hidrogênio por eletrólise da água, para depois utilizá-lo na síntese do ácido fórmico, a partir da hidrogenação catalítica de gás carbônico. A possibilidade de utilizar o ácido fórmico como combustível tem feito crescer a demanda mundial por esse produto. A figura abaixo ilustra como seria o ciclo de produção e consumo do ácido fórmico, conforme indica o texto.
a) Considerando as informações do texto e a figura ao lado, cite duas vantagens em se adotar a alternativa descrita.
b) A reação de síntese do ácido fórmico a partir da hidrogenação catalítica de gás carbônico, em fase gasosa, apresenta um valor muito pequeno de constante de equilíbrio. Visando a aumentar o seu rendimento, imagine que sejam promovidos, separadamente, um aumento do volume e um aumento da temperatura da mistura reacional em equilíbrio. Preencha a tabela abaixo de modo a informar o que ocorre com a quantidade de ácido fórmico. Use as palavras aumenta ou diminui e justifique cada escolha no espaço correspondente.
Na temperatura da síntese, considere que as entalpias de formação do gás carbônico, do ácido fórmico e do hidrogênio são (em kJ∙mol-1) -394, -363 e 0, respectivamente.
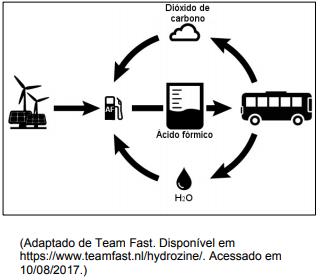

a) Baseando-se no enunciado e na figura, as duas vantagens em adotar esse processo seriam o uso de fontes não poluentes (eletricidade obtida a partir da energia eólica e solar) para a eletrólise da água; além disso, o CO2 produzido na combustão é usado no processo de hidrogenação catalítica do ácido fórmico, não acarretando um aumento de CO2 atmosférico.
b) Reação de síntese do ácido fórmico (HCOOH).
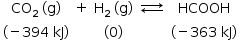

| Aumento de volume | Aumento da temperatura | |
|
Quantidade de |
Diminui | Aumenta |
| Justificativa | O aumento do volume faz com que a pressão do sistema diminua. Assim, o equilíbrio se desloca para o lado com maior número de mols de componentes gasosos (formação de CO2 e H2). |
Como a reação é endotérmica (ΔH = +31 kJ), o equilíbrio é deslocado para a direita (formação de HCOOH). |