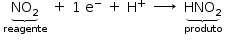Para investigar o efeito de diferentes poluentes na acidez da chuva ácida, foram realizados dois experimentos com os óxidos SO3 (g) e NO2 (g). No primeiro experimento, foram coletados 45 mL de SO3 em um frasco contendo água, que foi em seguida fechado e agitado, até que todo o óxido tivesse reagido. No segundo experimento, o mesmo procedimento foi realizado para o NO2. Em seguida, a solução resultante em cada um dos experimentos foi titulada com NaOH (aq) 0,1 mol/L, até sua neutralização.
As reações desses óxidos com água são representadas pelas equações químicas balanceadas:
H2O (ℓ) + SO3 (g) → H2SO4 (aq)
H2O (ℓ)+ 2 NO2 (g) → HNO2 (aq) + HNO3 (aq)
a) Determine o volume de NaOH (aq) utilizado na titulação do produto da reação entre SO3 e água. Mostre os cálculos.
b) Esse volume é menor, maior ou igual ao utilizado no experimento com NO2 (g)? Justifique.
c) Uma das reações descritas é de oxidorredução. Identifique qual é essa reação e preencha a tabela na folha de respostas, indicando os reagentes e produtos das semirreações de oxidação e de redução.
Reação:

Note e adote:
Considere os gases como Ideais e que a água comida nos frascos foi suficiente para a reação total com os óxidos.
Volume de 1 mol de gás: 22,5 L, nas condições em que os experimentos foram realizados.
a) Da soma das equações:
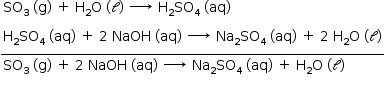
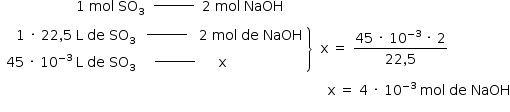
Na solução:
![«math style=¨font-family:Tahoma¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mrow»«mfenced open=¨[¨ close=¨]¨»«mi»NaOH«/mi»«/mfenced»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mfrac»«msub»«mi mathvariant=¨normal¨»n«/mi»«mi»sto«/mi»«/msub»«msub»«mi mathvariant=¨normal¨»V«/mi»«mi»s§#xE7;§#xE3;o«/mi»«/msub»«/mfrac»«mo»§#xA0;«/mo»«mo»§#x21D2;«/mo»«mo»§#xA0;«/mo»«mn»0«/mn»«mo»,«/mo»«mn»1«/mn»«mo»§#xA0;«/mo»«mfrac bevelled=¨true¨»«mi»mol«/mi»«mi mathvariant=¨normal¨»L«/mi»«/mfrac»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mfrac»«mrow»«mn»4«/mn»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»3«/mn»«/mrow»«/msup»«mo»§#xA0;«/mo»«mi»mol«/mi»«/mrow»«msub»«mi mathvariant=¨normal¨»V«/mi»«mi»s§#xE7;§#xE3;o«/mi»«/msub»«/mfrac»«mo»§#xA0;«/mo»«mo»§#xA0;«/mo»«mo»§#x2234;«/mo»«mo»§#xA0;«/mo»«msub»«mi mathvariant=¨normal¨»V«/mi»«mi»s§#xE7;§#xE3;o«/mi»«/msub»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mn»40«/mn»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»3«/mn»«/mrow»«/msup»«mo»§#xA0;«/mo»«mi mathvariant=¨normal¨»L«/mi»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mn»40«/mn»«mo»§#xA0;«/mo»«mi»mL«/mi»«/mrow»«/mstyle»«/math»](https://anglo.plurall.net/sites/all/libraries/ckeditor//plugins/ckeditor_wiris/integration/showimage.php?formula=fd3b9195c853a38dd87762de05a4a55b.png)
b) Da sequência de reações tem-se:
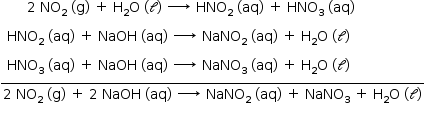
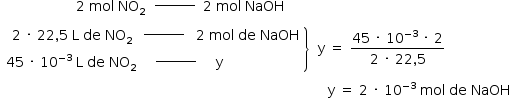
Da solução:
![«math style=¨font-family:Tahoma¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mfenced open=¨[¨ close=¨]¨»«mi»NaOH«/mi»«/mfenced»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mfrac»«msub»«mi mathvariant=¨normal¨»n«/mi»«mi»sto«/mi»«/msub»«msub»«mi mathvariant=¨normal¨»V«/mi»«mi»s§#xE7;§#xE3;o«/mi»«/msub»«/mfrac»«mo»§#xA0;«/mo»«mo»§#x21D2;«/mo»«mo»§#xA0;«/mo»«mn»0«/mn»«mo»,«/mo»«mn»1«/mn»«mo»§#xA0;«/mo»«mfrac bevelled=¨true¨»«mi»mol«/mi»«mi mathvariant=¨normal¨»L«/mi»«/mfrac»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mfrac»«mrow»«mn»2«/mn»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»3«/mn»«/mrow»«/msup»«mo»§#xA0;«/mo»«mi»mol«/mi»«/mrow»«msub»«mi mathvariant=¨normal¨»V«/mi»«mi»s§#xE7;§#xE3;o«/mi»«/msub»«/mfrac»«mo»§#xA0;«/mo»«mo»§#xA0;«/mo»«mo»§#x2234;«/mo»«mo»§#xA0;«/mo»«msub»«mi mathvariant=¨normal¨»V«/mi»«mi»s§#xE7;§#xE3;o«/mi»«/msub»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mn»20«/mn»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»3«/mn»«/mrow»«/msup»«mo»§#xA0;«/mo»«mi mathvariant=¨normal¨»L«/mi»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mn»20«/mn»«mo»§#xA0;«/mo»«mi»mL«/mi»«/mstyle»«/math»](https://anglo.plurall.net/sites/all/libraries/ckeditor//plugins/ckeditor_wiris/integration/showimage.php?formula=eaee9764601a3fb9f7a7bba8f152904a.png)
Portanto, o volume de NaOH (aq) empregado no experimento com SO3 (g) é maior que o empregado no experimento com NO2 (g)
c) Reação do tipo oxirredução:
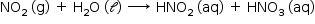
semirreação de oxidação:
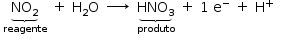
semirreação redução: