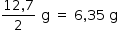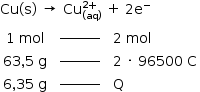Um estudante realizou um experimento para verificar a influência do arranjo de células eletroquímicas em um circuito elétrico. Para isso, preparou 3 células idênticas, cada uma contendo solução de sulfato de cobre (II) e dois eletrodos de cobre, de modo que houvesse corrosão em um eletrodo e deposição de cobre em outro. Em seguida, montou, sucessivamente, dois circuitos diferentes, conforme os Arranjos 1 e 2 ilustrados. O estudante utilizou uma fonte de tensão (F) e um amperímetro (A), o qual mediu uma corrente constante de 60 mA em ambos os casos.
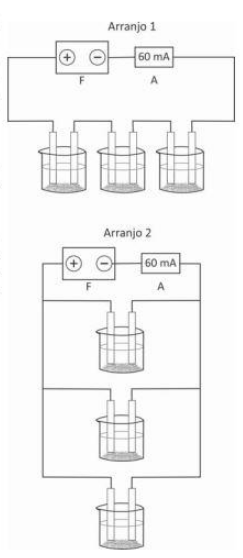
a) Considere que a fonte foi mantida ligada, nos arranjos 1 e 2, por um mesmo período de tempo. Em qual dos arranjos o estudante observará maior massa nos eletrodos em que ocorre deposição? Justifique.
b) Em um outro experimento, o estudante utilizou apenas uma célula eletroquímIca, contendo 2 eletrodos cilíndricos de cobre, de 12,7 g cada um, e uma corrente constante de 60 mA. Considerando que os eletrodos estão 50 % submersos, por quanto tempo o estudante pode deixar a célula ligada antes que toda a parte submersa do eletrodo que sofre corrosão seja consumida?
Note e adote:
Considere as três células eletroquimicas como resistores com resistências iguais. Massa molar do cobre: 63,5 g/mol
1 A = 1 C/s
Carga elétrica de 1 moi de elétrons: 96500 C.
a) O estudante observará maior massa no arranjo 1, pois as células eletroquímicas estão associadas em série. Logo, em cada célula, a corrente que se forma é de 60 mA. Já no arranjo 2, as células eletroquímicas estão associadas em paralelo, e, como a corrente elétrica total é de 60 mA, pode-se concluir que, em cada célula, é formada corrente de 20 mA, diminuindo a massa de cobre depositado. Desse modo, no arranjo 1 ocorre maior deposição de cobre.
b) Massa de cobre que oxida: