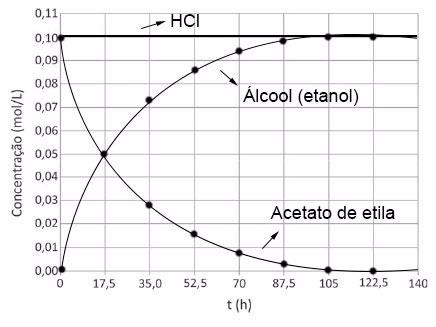
A reação química de hidrólise de ésteres de ácidos carboxllicos é catalisada por ácidos e segue uma cinética de primeira ordem. Uma solução aquosa 0,1 mol/L de acetato de etila praticamente não apresenta hidrólise em pH = 7; porém, ao se adicionar HCℓ até a concentração de 0,1 mol/L, observa-se hidrólise, de modo que a concentração de éster cai pela metade a cada 17,5 horas, ou seja, o tempo de meia-vida da reação de hidrólise do acetato de etila é considerado constante e igual a 17,5 horas. A reação prossegue até praticamente todo o éster reagir.
No quadriculado da folha de respostas, esboce os gráficos das concentrações de éster (acetato de etila), de álcool (etanol) e de HCℓ ao longo do tempo para essa reação, nomeando a curva referente a cada composto. Justifique sua resposta.
A reação de hidrólise do éster pode ser representada pela seguinte equação química:
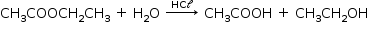
Nota-se por essa equação que, para cada um mol de éster consumido, há a formação de um mol de álcool.
Levando-se em conta que a meia–vida da reação de hidrólise é de 17,5 h e que o HCℓ é o catalisador da reação e, portanto, não é consumido no processo, tem-se: