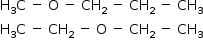A equação representa a combustão completa do butan-1-ol.
C4H9OH (ℓ) + xO2 (g) → yCO2 (g) + zH2O (ℓ) + 2670 kJ
a) Reescreva essa equação com os valores numéricos de x, y e z, indicando, ao lado da equação, a quantidade de energia envolvida utilizando a notação ∆H.
b) Escreva as fórmulas estruturais de dois isômeros de função do butan-1-ol.
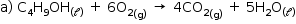
Balanceando a equação, obtêm-se os valores numéricos:
x = 6, y = 4 e z = 5
b) Os isômeros de função são: