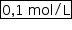Um volume de 100 mL de solução aquosa de sulfato de ferro(II) passou por um processo de evaporação lento e completo, obtendo-se 2,78 g de cristais de FeSO4 .7H2O.
a) A solução aquosa de sulfato de ferro(II) é condutora de corrente elétrica? Justifique sua resposta.
b) Calcule a quantidade de sal hidratado, em mol, obtido após a evaporação. Determine a concentração inicial de FeSO4 na solução, em mol/L, antes da evaporação.
a) O sulfato de ferro (II) heptaidratado irá dissociar de acordo com a seguinte equação:
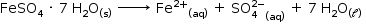
Logo, essa solução será condutora de corrente elétrica devido à mobilidade dos íons Fe2+(aq) e SO42–(aq).
b)

Em mol/L, a concentração do sal anidro FeSO4 será equivalente à do sal hidratado, portanto