A pirita (FeS2) é encontrada na natureza agregada a pequenas quantidades de níquel, cobalto, ouro e cobre. Os cristais de pirita são semelhantes ao ouro e, por isso, são chamados de ouro dos tolos. Esse minério é utilizado industrialmente para a produção de ácido sulfúrico. Essa produção ocorre em várias etapas, sendo que a primeira é a formação do dióxido de enxofre, segundo a equação a seguir.
Na segunda etapa, o dióxido de enxofre reage com oxigênio para formar trióxido de enxofre e, por fim, o trióxido de enxofre reage com água, dando origem ao ácido sulfúrico.
Sabendo que o minério de pirita apresenta 92% de pureza, calcule a massa aproximada de dióxido de enxofre produzida a partir de 200 g de pirita.
I) Cálculo de pureza:
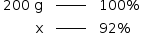
x = 184 g FeS2
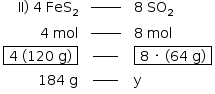
y = 196,26 g  196,5 g SO2
196,5 g SO2