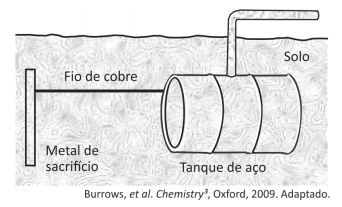
Um método largamente aplicado para evitar a corrosão em estruturas de aço enterradas no solo, como tanques e dutos, é a proteção catódica com um metal de sacrifício. Esse método consiste em conectar a estrutura a ser protegida, por meio de um fio condutor, a uma barra de um metal diferente e mais facilmente oxidável, que, com o passar do tempo, vai sendo corroído até que seja necessária sua substituição.
Um experimento para identificar quais metais podem ser utilizados como metal de sacrifício consiste na adição de um pedaço de metal a diferentes soluções contendo sais de outros metais, conforme ilustrado, e cujos resultados são mostrados na tabela. O símbolo ( + ) indica que foi observada uma reação química e o ( - ) indica que não se observou qualquer reação química.
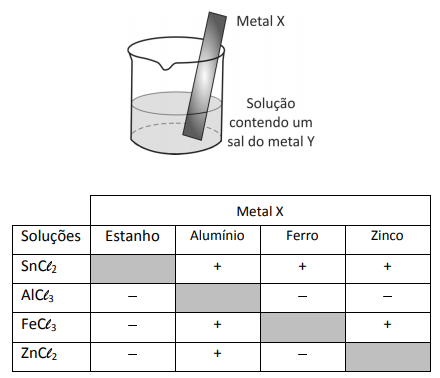
Da análise desses resultados, conclui-se que pode(m) ser utilizado(s) como metal(is) de sacrifício para tanques de aço:
Note e adote:
o aço é uma liga metálica majoritariamente formada pelo elemento ferro.
Para ocorrer reação, 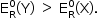
Pela análise da tabela, temos:
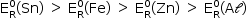
Para funcionar como metal de sacrifício, o metal precisa se oxidar, e ter, assim, um 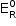 menor que o do Fe.
menor que o do Fe.
Conclui-se que os metais adequados são o Zn e o 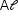 .
.