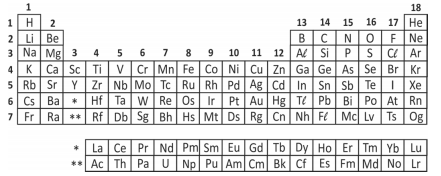
Analise a tabela periódica e as seguintes afirmações a respeito do elemento químico enxofre (S):
I. Tem massa atômica maior do que a do selênio (Se).
II. Pode formar com o hidrogênio um composto molecular de fórmula H2S.
III. A energia necessária para remover um elétron da camada mais externa do enxofre é maior do que para o sódio (Na).
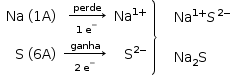
IV. Pode formar com o sódio (Na) um composto iônico de fórmula Na3S.
São corretas apenas as afirmações
A respeito das afirmações:
I - Incorreta. Para elementos de uma mesma família, a massa atômica aumenta de cima para baixo, portanto a massa atômica do selênio é maior que a do enxofre.
II - Correta. O composto mencionado é formado pelo hidrogênio e outro ametal (enxofre), logo trata-se de uma ligação covalente, formando o composto molecular de fórmula H2S.
III - Correta. Para elementos de um mesmo período, a energia para remover um elétron da camada mais externa aumenta da esquerda para direita, portanto, a energia para remover um elétron do enxofre é maior que a do sódio.
IV - Incorreta.