Carne Fraca

No primeiro semestre de 2017 a Polícia Federal divulgou detalhes da Operação Carne Fraca, revelando um esquema de adulteração de carne envolvendo fiscais do Ministério da Agricultura e vários frigoríficos. As informações divulgadas geraram preocupação não só em consumidores brasileiros, mas também em outros países importadores de carne brasileira.
Fraudes cometidas por comerciantes nacionais já foram relatadas anteriormente, especialmente no que se refere a carnes frescas. Ao contrário de carnes industrializadas, que recebem conservantes químicos para evitar desenvolvimento microbiano, a legislação determina que a carne fresca tem que ser isenta de aditivos. No entanto, alguns açougues e frigoríficos adicionam ilegalmente conservantes químicos como o nitrito (NO2-) e o sulfito (SO32-) à carne fresca, que deveria ser preservada contra a degradação microbiana apenas por meio de resfriamento ou congelamento.
O grande problema dos conservantes químicos em produtos cárneos é o seu excesso, sejam esses produtos oriundos da indústria ou de açougues e frigoríficos. O nitrito, por exemplo, quando ingerido em excesso, pode originar a metemoglobina após interagir com a hemoglobina. A metemoglobina apresenta o cátion ferro (III) e é incapaz de se ligar ao oxigênio (O2) reduzindo a capacidade do sangue de transportar essa substância aos tecidos, diferentemente da hemoglobina em que o íon metálico se encontra no estado de oxidação +2. A metemoglobina pode ser transformada novamente em hemoglobina por ação de uma enzima em uma reação em que o NADH é o outro reagente.

O sulfito, por sua vez, suprime odores desagradáveis e devolve a cor vermelho-viva a carnes de aspecto cinza-esverdeado, em vias de putrefação. No entanto, o uso do sulfito nessas circunstâncias tem eficiência limitada no controle de micro-organismos da carne, o que eleva o risco de intoxicação alimentar ao ingerir esse produto. Além disso, o excesso de sulfito pode provocar, em pessoas sensíveis, espasmos bronquiais. É importante também ressaltar que a ingestão de grandes quantidades de sulfito, e também de nitrito, eleva o risco de câncer.
• Questão 1
A) Determine o número de oxidação (Nox) dos átomos de S e N no ânions sulfito (SO32-) e nitrito (NO2-), respectivamente. O NADH age como agente redutor ou oxidante na transformação da metemoglobina em hemoglobina? Justifique a sua resposta.
B) Em produtos industrializados de carne como embutidos, a legislação brasileira permite uma concentração residual de 0,015 g de nitrito de sódio a cada 100 g de produto. Se uma peça de salame de 1,4 kg apresenta 4,0 x 10-3 mol de NaNO2, pode-se afirmar que o produto está em conformidade com a lei? Justifique.
Dado: Massa molar do NaNO2 = 69 g/mol
• Questão 2
A deterioração resulta principalmente da atividade de bactérias que se proliferam na carne. Vários gêneros bacterianos, como Pseudomonas, Clostridium, Enterococcus e Pediococcus, atuam sobre biomoléculas da carne, liberando gases fétidos e substâncias que alteram a cor e o sabor. O gráfico a seguir demonstra a dinâmica de crescimento de bactérias em carnes mantidas por vários dias nas temperaturas de 5°C, 10°C, 15°C e 20°C.

A) Qual o modo de reprodução das bactérias? Considerando que N1 seja o número de bactérias a partir do qual a carne começa a apresentar sinais de degradação, explique, com base no gráfico, o retardo na deterioração de carnes mantidas em baixas temperaturas.
B) O que ocorre com o crescimento bacteriano ao atingir o número N2 representado no gráfico, independentemente da temperatura considerada? Por que isso ocorre?
1. A) SO32-
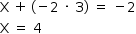
Nox do S = +4
NO2 –
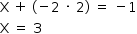
Nox do N = +3
Na transformação da metemoglobina em hemoglobina temos:
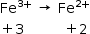
Redução.
Portanto, o Fe3+ atua como agente oxidante.
Como o NADH é o outro reagente ele atuara como agente redutor.
B) Calculando inicialmente a massa de NaNO2 ,presente no salame:
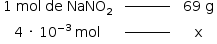
x = 0,276g
Para 100g de salame,teríamos
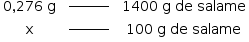
x = 0,0197g
Como a legislação brasileira permite uma concentração residual de 0,015 g de nitrito de sódio a cada 100 g de produto, pode-se afirmar que o produto não está em conformidade com a lei.
2. A) O modo habitual de reprodução bacteriana é a bipartição. A crescimento bacteriano diminui com a diminuição da temperatura do alimento. Isso ocorre porque a atividade das enzimas é alterada e as reações químicas de degradação dos alimentos diminuem.
B) A partir do número N2 representado no gráfico o crescimento bacteriano cessa, pois atingiu a capacidade limite do meio. Isso pode acontecer devido a exaustão dos nutrientes e o acúmulo de metabólitos produzidos pelas próprias bactérias. Neste momento as células progressivamente reduzem a taxa de crescimento e entram em uma fase de latência.