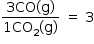
Foi realizada a combustão do gás butano em reator fechado. Inicialmente, a pressão parcial de gás butano era de 100 mbar, enquanto a pressão parcial de gás oxigênio era de 500 mbar.
• Considerando que todo butano e oxigênio foram consumidos e que os únicos produtos formados foram água, dióxido de carbono e monóxido de carbono, pode-se afirmar que a relação entre a pressão parcial de CO e a pressão parcial de CO2, após o término da reação, é aproximadamente igual a
V = constante
T = constante
P inicial do butano = 100 mbar
P inicial do oxigênio = 500 mbar
As relações entre as pressões parciais, nestas condições, são proporcionais ao número de mol. Assim teríamos: 1 mol de butano para 5 mol de oxigênio.
Segundo texto esses reagentes foram totalmente consumidos, sendo formados, dióxido de carbono , monóxido de carbono e água.
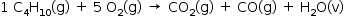
Balanceando a equação teremos:
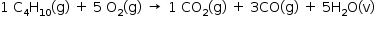
A relação entre os número de mol será igual relação das pressões parciais: