O trióxido de enxofre (SO3) é obtido a partir da reação do dióxido de enxofre (SO2) com o gás oxigênio (O2), representada pelo equilíbrio a seguir.
2 SO2 (g) + O2 (g) 2 SO3 (g) ΔHθ = - 198 kJ
A constante de equilíbrio, KC, para esse processo a 1000 ºC é igual a 280. A respeito dessa reação, foram feitas as seguintes afirmações:
I. A constante de equilíbrio da síntese do SO3 a 200 ºC deve ser menor que 280.
II. Se na condição de equilíbrio a 1000 ºC a concentração de O2 é de 0,1 mol.L-1 e a concentração de SO2 é de 0,01 mol.L-1, então a concentração de SO3 é de 2,8 mol.L-1.
III. Se, atingida a condição de equilíbrio, o volume do recipiente for reduzido sem alteração na temperatura, não haverá alteração no valor da constante de equilíbrio, mas haverá aumento no rendimento de formação do SO3.
IV. Essa é uma reação de oxirredução, em que o dióxido de enxofre é o agente redutor.
• Estão corretas apenas as afirmações:
2 SO2(g) + 1 O2(g) = 2 SO3(g) 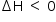
I – Falsa.
Como a reação é exotérmica, o resfriamento provoca um deslocamento para direita com consequente aumento da constante de equilíbrio.
II – Falsa.
![«math style=¨font-family:Tahoma¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mrow»«msub»«mi mathvariant=¨normal¨»K«/mi»«mi mathvariant=¨normal¨»c«/mi»«/msub»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mfrac»«mfenced open=¨[¨ close=¨]¨»«msub»«mi»SO«/mi»«mn»3«/mn»«/msub»«/mfenced»«mrow»«msup»«mfenced open=¨[¨ close=¨]¨»«msub»«mi»SO«/mi»«mn»2«/mn»«/msub»«/mfenced»«mn»2«/mn»«/msup»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«mfenced open=¨[¨ close=¨]¨»«msub»«mi mathvariant=¨normal¨»O«/mi»«mn»2«/mn»«/msub»«/mfenced»«/mrow»«/mfrac»«mo»§#xA0;«/mo»«mo»§#x21D2;«/mo»«mo»§#xA0;«/mo»«mn»280«/mn»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mfrac»«mrow»«mo»(«/mo»«mi mathvariant=¨normal¨»x«/mi»«msup»«mo»)«/mo»«mn»2«/mn»«/msup»«/mrow»«mrow»«mo»(«/mo»«mn»0«/mn»«mo»,«/mo»«mn»01«/mn»«msup»«mo»)«/mo»«mn»2«/mn»«/msup»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«mo»(«/mo»«mn»0«/mn»«mo»,«/mo»«mn»1«/mn»«mo»)«/mo»«/mrow»«/mfrac»«mo»§#xA0;«/mo»«mo»§#x21D2;«/mo»«mo»§#xA0;«/mo»«mi mathvariant=¨normal¨»x«/mi»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mn»0«/mn»«mo»,«/mo»«mn»053«/mn»«mo»§#xA0;«/mo»«mfrac»«mi»mol«/mi»«mi mathvariant=¨normal¨»L«/mi»«/mfrac»«/mrow»«/mstyle»«/math»](https://anglo.plurall.net/sites/all/libraries/ckeditor//plugins/ckeditor_wiris/integration/showimage.php?formula=f0941d97446dd38a6394cdd9e33edc01.png)
III – Verdadeira.
Ao se reduzir o volume do frasco (aumentar a pressão), ocorre um deslocamento para a direita com consequente aumento no rendimento na obtenção do SO3. Como a temperatura não foi alterada, não há alteração do valor da constante de equilíbrio.
IV – Verdadeira.
A reação é oxirredução e ocorre aumento do Nox do enxofre (+4 para +6), logo o SO2 é o agente redutor.