Muitos medicamentos analgésicos contêm, em sua formulação, o ácido acetilsalicílico, que é considerado um ácido fraco (constante de ionização do ácido acetilsalicílico = 3,2 x 10-4). A absorção desse medicamento no estômago do organismo humano ocorre com o ácido acetilsalicílico em sua forma não ionizada.
a) Escreva a equação química que representa a ionização do ácido acetilsalicílico em meio aquoso, utilizando fórmulas estruturais.
b) Escreva a expressão da constante de equilíbrio para a ionização do ácido acetilsalicílico. Para isto, utilize o símbolo AA para a forma não ionizada e o símbolo AA- para a forma ionizada.
c) Considere um comprimido de aspirina contendo 540 mg de ácido acetilsalicílico, totalmente dissolvido em água, sendo o volume da solução 1,5 L. Calcule a concentração, em mol/L, dos íons H+ nessa solução. Em seus cálculos, considere que a variação na concentração inicial do fármaco, devido à sua ionização, é desprezível.
d) No pH do suco gástrico, a absorção do fármaco será eficiente? Justifique sua resposta.
Note e adote:
pH do suco gástrico: 1,2 a 3,0
Massa molar do ácido acetilsalicílico: 180 g/mol
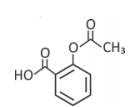
Ácido acetilsalicílico:
a)
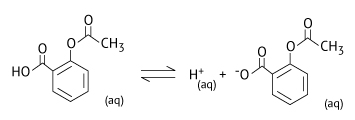
b) ![«math style=¨font-family:Tahoma¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mrow»«msub»«mi mathvariant=¨normal¨»K«/mi»«mi mathvariant=¨normal¨»c«/mi»«/msub»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mfrac»«mrow»«mo»[«/mo»«msup»«mi mathvariant=¨normal¨»H«/mi»«mo»+«/mo»«/msup»«mo»]«/mo»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«mo»[«/mo»«msup»«mi»AA«/mi»«mo»-«/mo»«/msup»«mo»]«/mo»«/mrow»«mrow»«mo»[«/mo»«mi»AA«/mi»«mo»]«/mo»«/mrow»«/mfrac»«/mrow»«/mstyle»«/math»](https://anglo.plurall.net/sites/all/libraries/ckeditor//plugins/ckeditor_wiris/integration/showimage.php?formula=2671bf427448f0b66d8952a0b5f57037.png)
c) Cálculo da concentração molar do ácido acetilsalicílico:
![«math style=¨font-family:Tahoma¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mrow»«mfenced open=¨¨ close=¨}¨»«mtable columnalign=¨right right left¨»«mtr»«mtd»«mn»180«/mn»«mo»§#xA0;«/mo»«mi mathvariant=¨normal¨»g«/mi»«/mtd»«mtd»«msup»«maction actiontype=¨argument¨»«mrow/»«/maction»«mi»____«/mi»«/msup»«maction actiontype=¨argument¨»«mrow/»«/maction»«/mtd»«mtd»«mn»1«/mn»«mo»§#xA0;«/mo»«mi»mol«/mi»«/mtd»«/mtr»«mtr»«mtd»«mn»540«/mn»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»3«/mn»«/mrow»«/msup»«mo»§#xA0;«/mo»«mi mathvariant=¨normal¨»g«/mi»«/mtd»«mtd»«msup»«maction actiontype=¨argument¨»«mrow/»«/maction»«mi»____«/mi»«/msup»«maction actiontype=¨argument¨»«mrow/»«/maction»«/mtd»«mtd»«mi mathvariant=¨normal¨»x«/mi»«/mtd»«/mtr»«/mtable»«/mfenced»«mo»§#xA0;«/mo»«mi mathvariant=¨normal¨»x«/mi»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mn»3«/mn»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»3«/mn»«/mrow»«/msup»«mo»§#xA0;«/mo»«mi»mol«/mi»«mspace linebreak=¨newline¨/»«mo»[«/mo»«mi»AA«/mi»«mo»]«/mo»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mfrac»«mrow»«mn»3«/mn»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»3«/mn»«/mrow»«/msup»«mo»§#xA0;«/mo»«mi»mol«/mi»«/mrow»«mrow»«mn»1«/mn»«mo»,«/mo»«mn»5«/mn»«mo»§#xA0;«/mo»«mi mathvariant=¨normal¨»L«/mi»«/mrow»«/mfrac»«mo»§#xA0;«/mo»«mo»=«/mo»«mo»§#xA0;«/mo»«mn»2«/mn»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»3«/mn»«/mrow»«/msup»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«mspace linebreak=¨newline¨/»«/mrow»«/mstyle»«/math»](https://anglo.plurall.net/sites/all/libraries/ckeditor//plugins/ckeditor_wiris/integration/showimage.php?formula=39229344b18166d3e6840f8816a5ca94.png)
Cálculo da concentração de H+ (mol/L):
![«math style=¨font-family:Tahoma¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle indentalign=¨left¨ mathsize=¨14px¨»«mtable columnalign=¨center center center center center center¨»«mtr»«mtd/»«mtd»«mi»AA«/mi»«/mtd»«mtd»«mo»§#x21CC;«/mo»«/mtd»«mtd»«msup»«mi mathvariant=¨normal¨»H«/mi»«mo»+«/mo»«/msup»«/mtd»«mtd»«mo»+«/mo»«/mtd»«mtd»«msup»«mi»AA«/mi»«mo»-«/mo»«/msup»«/mtd»«/mtr»«mtr»«mtd»«mo»(«/mo»«mi»in§#xED;cio«/mi»«mo»)«/mo»«/mtd»«mtd»«mn»2«/mn»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»3«/mn»«/mrow»«/msup»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«/mtd»«mtd/»«mtd»«mn»0«/mn»«/mtd»«mtd/»«mtd»«mn»0«/mn»«/mtd»«/mtr»«mtr»«mtd»«mo»(«/mo»«mi»ioniza«/mi»«mo»)«/mo»«/mtd»«mtd»«mi mathvariant=¨normal¨»x«/mi»«/mtd»«mtd/»«mtd»«mi mathvariant=¨normal¨»x«/mi»«/mtd»«mtd/»«mtd»«mi mathvariant=¨normal¨»x«/mi»«/mtd»«/mtr»«mtr»«mtd»«mo»(«/mo»«mi»equil§#xED;brio«/mi»«mo»)«/mo»«/mtd»«mtd»«mo»§#x2245;«/mo»«mo»§#xA0;«/mo»«mn»2«/mn»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»3«/mn»«/mrow»«/msup»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«/mtd»«mtd/»«mtd»«mi mathvariant=¨normal¨»x«/mi»«/mtd»«mtd/»«mtd»«mi mathvariant=¨normal¨»x«/mi»«/mtd»«/mtr»«/mtable»«mspace linebreak=¨newline¨/»«mspace linebreak=¨newline¨/»«mtable columnalign=¨right center left¨»«mtr»«mtd»«msub»«mi mathvariant=¨normal¨»K«/mi»«mi mathvariant=¨normal¨»c«/mi»«/msub»«/mtd»«mtd»«mo»=«/mo»«/mtd»«mtd»«mfrac»«mrow»«mo»[«/mo»«msup»«mi mathvariant=¨normal¨»H«/mi»«mo»+«/mo»«/msup»«mo»]«/mo»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«mo»[«/mo»«msup»«mi»AA«/mi»«mo»-«/mo»«/msup»«mo»]«/mo»«/mrow»«mrow»«mo»[«/mo»«mi»AA«/mi»«mo»]«/mo»«/mrow»«/mfrac»«/mtd»«/mtr»«mtr»«mtd»«mn»3«/mn»«mo»,«/mo»«mn»2«/mn»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»4«/mn»«/mrow»«/msup»«/mtd»«mtd»«mo»=«/mo»«/mtd»«mtd»«mfrac»«mrow»«mi mathvariant=¨normal¨»x«/mi»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«mi mathvariant=¨normal¨»x«/mi»«/mrow»«mrow»«mn»2«/mn»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»3«/mn»«/mrow»«/msup»«/mrow»«/mfrac»«/mtd»«/mtr»«mtr»«mtd»«msup»«mi mathvariant=¨normal¨»x«/mi»«mn»2«/mn»«/msup»«/mtd»«mtd»«mo»=«/mo»«/mtd»«mtd»«mn»64«/mn»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»8«/mn»«/mrow»«/msup»«/mtd»«/mtr»«mtr»«mtd»«mi mathvariant=¨normal¨»x«/mi»«/mtd»«mtd»«mo»=«/mo»«/mtd»«mtd»«mn»8«/mn»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»4«/mn»«/mrow»«/msup»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«/mtd»«/mtr»«mtr»«mtd»«mo»[«/mo»«msup»«mi mathvariant=¨normal¨»H«/mi»«mo»+«/mo»«/msup»«mo»]«/mo»«/mtd»«mtd»«mo»=«/mo»«/mtd»«mtd»«mn»8«/mn»«mo»§#xA0;«/mo»«mo»§#xB7;«/mo»«mo»§#xA0;«/mo»«msup»«mn»10«/mn»«mrow»«mo»-«/mo»«mn»4«/mn»«/mrow»«/msup»«mo»§#xA0;«/mo»«mi»mol«/mi»«mo»/«/mo»«mi mathvariant=¨normal¨»L«/mi»«/mtd»«/mtr»«/mtable»«/mstyle»«/math»](https://anglo.plurall.net/sites/all/libraries/ckeditor//plugins/ckeditor_wiris/integration/showimage.php?formula=3c7588f130791cf20b753663f019ef7d.png)
d) A absorção do fármaco será eficiente, pois no estômago (onde o pH é ácido) o equilíbrio de ionização do ácido acetilsalicílico estará deslocado para a esquerda, onde predomina a forma não ionizada, que é a forma do medicamento absorvido pelo organismo.