Uma das formas de se medir temperaturas em fase gasosa é por meio de reações com constantes de equilíbrio muito bem conhecidas, chamadas de reações-termômetro. Uma dessas reações, que ocorre entre o ânion tiofenolato e o 2,2,2-trifluoroetanol, está representada pela equação química
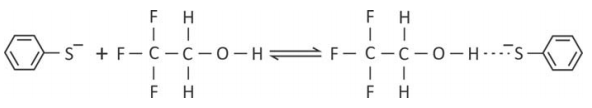
Para essa reação, foram determinados os valores da constante de equilíbrio em duas temperaturas distintas.
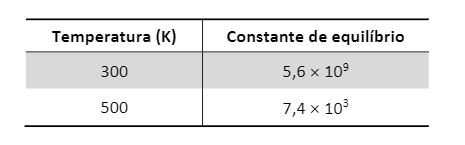
a) Essa reação é exotérmica ou endotérmica? Explique, utilizando os dados de constante de equilíbrio apresentados.
b) Explique por que, no produto dessa reação, há uma forte interação entre o átomo de hidrogênio do álcool e o átomo de enxofre do ânion.
a) A reação é exotérmica. A tabela mostra que em menor temperatura a constante de equilíbrio possui maior valor. Isso permite concluir que o resfriamento desloca o equilíbrio no sentido direto, aumentando o rendimento do produto, ou seja, a reação direta é exotérmica.
b) O átomo de hidrogênio do álcool está ligado diretamente ao oxigênio, um elemento de alta eletronegatividade. Isso o torna muito polarizado positivamente, daí a forte interação com o enxofre do ânion (interação íon-dipolo).