Para estudar a velocidade da reação entre carbonato de cobre (CuCO3) e ácido nítrico (HNO3), foram feitos três experimentos, em que o volume de dióxido de carbono (CO2) produzido foi medido em vários intervalos de tempo. A tabela apresenta as condições em que foram realizados esses experimentos. Nos três experimentos, foram utilizadas massas idênticas de carbonato de cobre e a temperatura foi mantida constante durante o tempo em que as reações foram acompanhada.
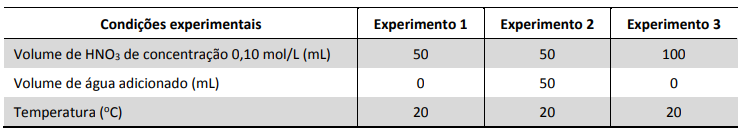
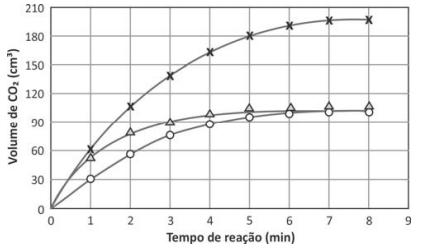
Os dados obtidos nos três experimentos foram representados em um gráfico de volume de CO2 em função do tempo de reação. Esse gráfico está apresentado a seguir.
a) Escreva a equação química balanceada que representa a reação que ocorreu entre o carbonato de cobre e o ácido nítrico.
b) Com base nas condições empregadas em cada experimento, complete a legenda do gráfico, na página de respostas, com o número do experimento. Considere irrelevante a perda de volume de CO2 coletado devido à dissolução na solução. Justifique suas respostas.
c) Nos três experimentos, o mesmo reagente estava em excesso. Qual é esse reagente? Explique.
a) 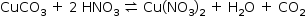
b)

A curva 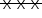 representa o experimento 3, uma vez que há maior quantidade de reagente disponível. Os experimentos 1 e 2 foram realizados com a mesma quantidade de reagente; assim, a quantidade de produto formada foi a mesma. Entretanto, a concentração de ácido no experimento 2 é menor, o que implica a redução da velocidade de formação do produto. Portanto, o experimento 2 se refere à curva
representa o experimento 3, uma vez que há maior quantidade de reagente disponível. Os experimentos 1 e 2 foram realizados com a mesma quantidade de reagente; assim, a quantidade de produto formada foi a mesma. Entretanto, a concentração de ácido no experimento 2 é menor, o que implica a redução da velocidade de formação do produto. Portanto, o experimento 2 se refere à curva 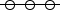 e o experimento 1, à curva
e o experimento 1, à curva 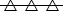 .
.
c) A quantidade de produto formada varia em função da quantidade de reagente limitante consumida. Do enunciado, tem-se que a massa de CuCO3 é igual nos três experimentos e apenas a quantidade de ácido varia. Assim, pode-se concluir que o HNO3 é o reagente limitante e o CuCO3 está em excesso.