Sob certas condições, tanto o gás flúor quanto o gás cloro podem reagir com hidrogênio gasoso, formando, respectivamente, os haletos de hidrogênio HF e HCℓ, gasosos. Pode-se estimar a variação de entalpia (ΔH) de cada uma dessas reações, utilizando-se dados de energia de ligação. A tabela apresenta os valores de energia de ligação dos reagentes e produtos dessas reações a 25 °C e 1 atm.
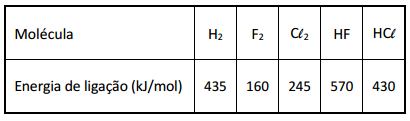
Com base nesses dados, um estudante calculou a variação de entalpia (ΔH) de cada uma das reações e concluiu, corretamente, que, nas condições empregadas,
Com os dados das energias de ligação, é possível determinar o ΔH das reações representadas pelas equações abaixo:
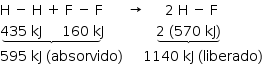
Como o calor liberado é maior que o absorvido, a reação é exotérmica, e o valor do ΔH é –545 kJ.
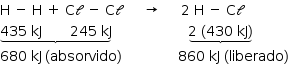
Como o calor liberado é maior que o absorvido, a reação é exotérmica, e o valor do ΔH é –180 kJ.