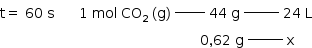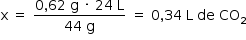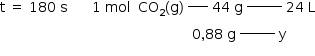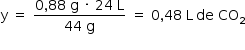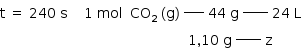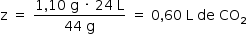Em uma aula experimental, dois grupos de alunos (G1 e G2) utilizaram dois procedimentos diferentes para estudar a velocidade da reação de carbonato de cálcio com excesso de ácido clorídrico. As condições de temperatura e pressão eram as mesmas nos dois procedimentos e, em cada um deles, os estudantes empregaram a mesma massa inicial de carbonato de cálcio e o mesmo volume de solução de ácido clorídrico de mesma concentração.
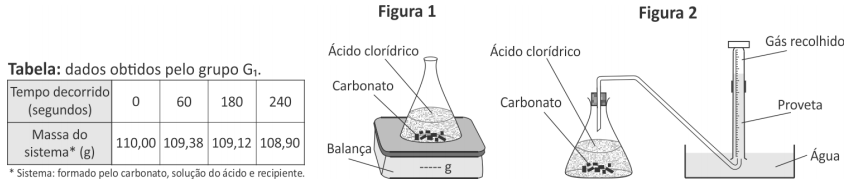
O grupo G1 acompanhou a transformação ao longo do tempo, realizada em um sistema aberto, determinando a variação de massa desse sistema (Figura 1 e Tabela).
O grupo G2 acompanhou essa reação ao longo do tempo, porém determinando o volume de dióxido de carbono recolhido (Figura 2).
Comparando os dois experimentos, os volumes aproximados de CO2, em litros, recolhidos pelo grupo G2 após 60, 180 e 240 segundos devem ter sido, respectivamente,
Note e adote:
massa molar do CO2: 44 g/mol;
volume molar do CO2: 24 L/mol;
desconsidere a solubilidade do CO2 em água.
Os dois experimentos foram realizados nas mesmas condições (mesma quantidade de CaCO3(s) e HCl(aq)), mesma temperatura e mesma pressão), de modo que a quantidade de gás carbônico formada, a cada instante, é a mesma em ambos os casos. A equação química que descreve a reação em questão é:
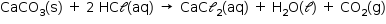
A variação da massa do sistema sobre a balança no experimento 1 deve-se à quantidade de CO2 liberado.
| Tempo decorrido (segundos) | 0 | 60 | 180 | 240 |
| Massa do sistema (g) | 110,00 | 109,38 | 109,12 | 108,90 |
| Massa de CO2 liberado (g) | 0 | 0,62 g | 0,88 g | 1,10 g |
Assim, o volume de gás carbônico formado no experimento 2 corresponde à mesma quantidade de gás carbônico formada no experimento 1.
Portanto: