No mergulho autônomo, usa-se cilindro contendo uma mistura de gases comprimidos que são inspirados pelo mergulhador e expirados para o ambiente, na forma de bolhas. Um risco associado a essa prática é a embolia causada pelo acúmulo de N2 nos tecidos do corpo quando esse gás é respirado em pressões parciais elevadas por longos períodos. A embolia pode ser evitada planejando-se a profundidade e o tempo do mergulho. Respirar N2 a uma pressão parcial de 1,58 atm por até 10 minutos não é prejudicial à saúde. O tempo de mergulho pode ser aumentado empobrecendo a mistura gasosa do cilindro em N2 e enriquecendo em O2 até pressão parcial de 1,4 atm, pois, acima desse valor, passa a apresentar caráter tóxico.
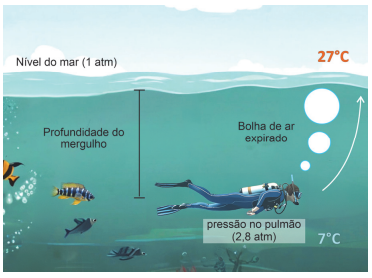
Considerando que a pressão atmosférica ao nível do mar é 1 atm e que, a cada 10 m de coluna de água, a pressão aumenta em 1 atm, responda:
a) Um cilindro de mergulho de 12,3 litros de capacidade foi preenchido apenas com O2 a 140 atm a 27 °C. Qual a massa de O2 contida no cilindro?
b) Considere um mergulho de 10 minutos a uma profundidade constante utilizando um cilindro contendo apenas N2 e O2. Sabendo que o mergulho foi realizado no limite imposto pela toxicidade do O2 (PO2 = 1,4 atm) e pelo risco de embolia por N2 (PN2 = 1,58 atm), qual a profundidade do mergulho? Qual a composição porcentual, em mol, da mistura gasosa no cilindro do mergulhador? Desconsidere o tempo de descida e subida do mergulho.
c) Considere o mergulho descrito na figura ao lado, no qual a pressão nos pulmões do mergulhador é de 2,8 atm e a temperatura é de 7 °C. Sabendo que o cilindro está preenchido com uma pressão de 140 atm e que o volume inspirado pelo mergulhador é de 0,5 L e é igual ao volume expirado, qual será o volume de ar consumido do cilindro a cada inspiração? Assuma que, nesse processo, a temperatura do gás se mantém constante a 7 °C. Qual o volume da bolha de ar expirado quando ela atinge a superfície, onde a pressão é de 1 atm e a temperatura de 27 °C?
Note e adote:
Constante dos gases ideais: R = 0,082 atm L/ K mol
T(K) = T(°C) + 273
Massa molar (g/mol): O2 = 32
a) A massa de oxigênio no cilindro a 300 K é:
b)
Sabemos que a pressão total é a soma da pressão atmosférica ao nível do mar (1 atm) e da pressão da coluna de água na profundidade (h). A pressão na profundidade pode ser dada por:
Portanto, a profundidade do mergulho é de aproximadamente 19,8 metros.
c) P1 = Pressão nos pulmões = 2,8 atm
Temperatura constante = 7 ºC = 280 K
P2 = Pressão no cilindro = 140 atm
V1 = Volume inspirado = 0,5 L
V2 = ?
Pressão nos pulmões (no momento da expiração): P1 = 2,8 atm
Volume expirado: V1 = 0,5 L
Pressão na superfície: P2 = 1 atm
Temperatura nos pulmões: T1 = 7 ºC = 280 K
Temperatura na superfície: T2 = 27 ºC = 300 K
V2 = ?