Água contendo concentrações superiores a 150 mg/L de íons Ca2+ e Mg2+ é chamada de água dura, que é imprópria para algumas aplicações domésticas e industriais, pois esses íons reagem com sabão formando sais insolúveis. Para evitar esse contratempo, alguns processos de tratamento de água envolvem adição de reagentes químicos para precipitação dos íons Ca2+ e Mg2+. Avaliando as três situações distintas a seguir, responda:
a) Para o tratamento da água dura, dispõe-se dos seguintes compostos: Na3PO4, Na2CO3, NaOH e Na2SO4. Qual deles seria utilizado em menor quantidade, em mol, para o tratamento de água dura?
b) Um possível procedimento usado para a retirada dos íons Ca2+ e Mg2+ da água consiste em adicionar cal apagada [Ca(OH)2] até saturar a solução. Posteriormente, adiciona-se Na2CO3. Com esse procedimento, qual íon será o primeiro a ser retirado? Escreva as fórmulas químicas dos precipitados formados.
c) Considere uma caixa d’água com 10.000 L de água contendo 150 mg/L de Ca2+. Qual a massa de Na2CO3, em quilograma, que deve ser adicionada para que a concentração de Ca2+ seja reduzida a 70 mg/L?
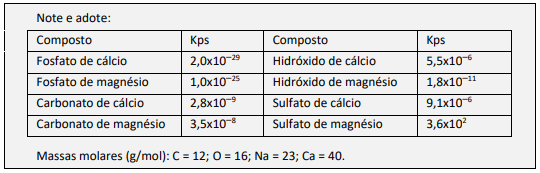
a) O sal adicionado à água dura deve conter ânions que formem compostos pouco solúveis com cálcio e magnésio. O sal utilizado em menor quantidade em mol deve gerar compostos com os menores valores de solubilidade, ou seja, menores valores de Kps. Os valores de Kps mais baixos são os do fosfato de cálcio e do fosfato de magnésio. Assim, o sal adicionado em menor quantidade e que precipita cálcio e magnésio com maior eficiência (gerando compostos menos solúveis) é o Na₃PO₄.
b) O primeiro íon a ser retirado é o magnésio (Mg2+). A adição de cal apagada até saturar a solução faz precipitar o íon magnésio na forma de hidróxido de magnésio. Na sequência, a adição de carbonato de sódio (Na2CO3) faz precipitar o carbonato de cálcio. As fórmulas dos precipitados são: Mg(OH)2 – hidróxido de magnésio e CaCO3 – carbonato de cálcio.
c) A diminuição da concentração de cálcio é: 150 mg/L – 70 mg/L = 80mg/L.
Essa diminuição corresponde a uma massa de:
A reação entre o sal (Na2CO3) e o íon Ca2+ pode ser representada pela seguinte equação: