A produção enzimática de hidrogênio a partir da glicose e água foi estudada do ponto de vista cinético e termodinâmico, revelando ser possível obter alto rendimento de H2 em condições suaves de reação: temperatura ambiente e pressão atmosférica. Com melhorias tecnológicas e integração com células de combustível, essa tecnologia também permitiria resolver alguns dos desafios associados ao armazenamento, à distribuição e à infraestrutura na economia baseada no H2.
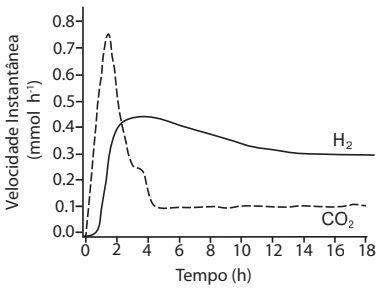
a) A figura acima mostra a velocidade instantânea de formação de hidrogênio e dióxido de carbono em função do tempo do processo estudado. A equação química que representa quantitativamente o resultado desse processo é dada por:
C6H12O6(aq) +6 H2O(aq) → 12 H2(g) + 6 CO2(g)
Levando em conta essas informações, em que tempo a razão entre as velocidades instantâneas de formação dos produtos se iguala à razão entre seus coeficientes estequiométricos? Justifique.
b) Do ponto de vista termodinâmico, para a discussão dos resultados os autores utilizam o diagrama de energia (aqui incompleto) fornecido no campo de respostas. A partir desse diagrama, resolva: (i) no decorrer do processo sob estudo, o meio reacional tenderia a um aumento ou a uma diminuição da temperatura? Justifique. (ii) Calcule o valor da entalpia molar da reação de formação da água.
a) A razão entre os coeficientes estequiométricos é:
Para que a razão entre as velocidades instantâneas de formação dos produtos se iguale à razão estequiométrica, a velocidade de H2 deve ser o dobro da de CO2, o que ocorre em torno de 3,5 horas.
Razão entre as velocidades instantâneas de formação dos produtos:
b) Pela análise do diagrama de energia, temos:
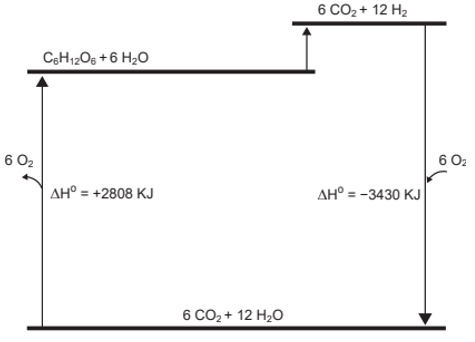
Ajustando os coeficientes das substâncias:
Ajustando os coeficientes das substâncias:
Para calcular a energia da reação: , devemos:
Inverter as reações 1 e 2:
Dessa forma, como a reação é endotérmica, o meio reacional tenderia a uma diminuição da temperatura.
Para calcular o valor da entalpia molar da reação de formação da água, devemos dividir a reação e seu respectivo ΔH de - 3430 kJ por 12.