A reação do antibiótico sulfanilamida com halogênios leva à reação de substituição com o halogênio em duas posições distintas do anel aromático, como representado na equação não balanceada a seguir.
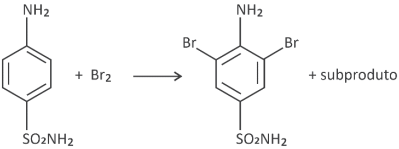
Em um experimento, 1 L de uma solução de sulfanilamida de pH 5 reagiu com Br2 em excesso, obtendo-se pH 4 após reação total. Considerando que o volume se manteve inalterado após a adição do halogênio, quantos mols de sulfanilamida reagiram com bromo?
I) Para um pH = 5 temos uma concentração de íons H+ de 1 · 10-5 mol/L (0,1 · 10-4 mol/L)
Para um pH = 4 temos uma concentração de íons H+ de 1 · 10-4 mol/L
II) Como o pH diminui, tem-se um aumento na concentração de íons H+ dado por:
Como o volume da solução é de 1 L, foram formados 0,9 · 10-4 mol de íons H+
III) Da reação, para cada 1 mol de sulfanilamida que reage são formados 2 mols de HBr (2 mol íons H+)